Nomenclatura Internazionale degli alcani. Alcani: struttura, proprietà
Sarà utile cominciare definendo il concetto di alcani. Questi sono idrocarburi saturi o saturi, paraffine. Si può anche dire che questi sono carboni in cui la combinazione di atomi C viene effettuata attraverso semplici legami. La formula generale ha la forma: CnH2n + 2.
È noto che il rapporto tra il numero di atomi H e C nelle loro molecole è massimizzato se confrontato con altre classi. Tenuto conto del fatto che tutte le valenze sono occupate da C o H, le proprietà chimiche degli alcani non sono chiaramente espresse, quindi il secondo termine è il termine idrocarburi saturi o saturi.
C'è anche un nome più vecchio, che meglio riflette la relativa chimica relativa – paraffine, che in traduzione significa "privo di affinità".
Quindi, il tema della nostra conversazione odierna è: "Alkans: serie di omologia, nomenclatura, struttura, isomerismo". Saranno inoltre presentati dati sulle loro proprietà fisiche.
Alkani: costruzione, nomenclatura
In essi, gli atomi C sono in uno stato dello sp3-ibridazione. A questo proposito, la molecola di alcano può essere dimostrata come un insieme di strutture C tetraedriche non solo correlate tra loro, ma anche a H. 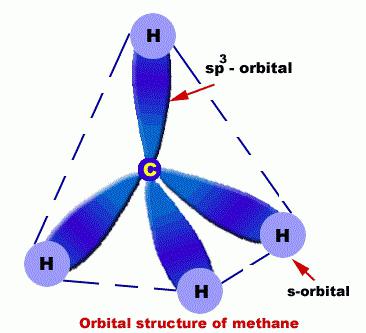
Tra gli atomi C e H vi sono forti e basse bassissime polarità. Atomi intorno a legami semplici ruotano sempre, in modo che le molecole di alcani assumano una varietà di forme, con la lunghezza della connessione, l'angolo tra di loro – valori costanti. Le forme che si trasformano l'una nell'altra a causa della rotazione della molecola che si verifica intorno ai legami σ, è consuetudine chiamarla conformazioni. 
Durante il distacco dell'atomo H dalla molecola in questione, si formano particelle 1 valenti, dette radici di idrocarburi. Essi appaiono come risultato di composti non solo di sostanze organiche, ma anche di composti inorganici. Se prendiamo due atomi di idrogeno dalla molecola dell'idrogeno limitante, otteniamo radicali a 2 valenze.
Pertanto, la nomenclatura di alcani può essere:
- Radiale (vecchia versione);
- Sostituto (internazionale, sistematico). È proposta da IUPAC.
Caratteristiche della nomenclatura radiale
Nel primo caso, la nomenclatura di alcani è caratterizzata da:
- Considerazione degli idrocarburi come derivati del metano, in cui uno o più atomi H sono sostituiti da radicali.
- Elevato grado di comodità nel caso di connessioni non molto complesse.
Caratteristiche della nomenclatura di sostituzione
La nomenclatura di alcani ha le seguenti caratteristiche:
- La base del nome è una catena di carbonio, mentre i rimanenti frammenti molecolari sono considerati come sostituenti.
- In presenza di diversi radicali identici, prima del loro nome è indicato il numero (rigorosamente in parole), ei numeri radici sono separati da virgole.
Chimica: nomenclatura di alcani
Per comodità, le informazioni sono presentate sotto forma di tabella.
|
Nome della sostanza |
La base del nome (root) |
Formula molecolare |
Il nome del carbonio sostituente |
La formula di sostituzione del carbonio |
|
metano |
meth |
CH ^ |
metile |
CH |
|
etano |
etno |
C₂H₆ |
etilico |
C H |
|
propano |
puntellare |
C₃H₈ |
È ubriaco |
C₃H₇ |
|
butano |
ma- |
C₄H₁₀ |
butil |
C₄H₉ |
|
pentano |
rinchiuso |
C₅H₁₂ |
pentil |
C₅H₁₁ |
|
esano |
hex |
C₆H₁₄ |
esil |
C₆H₁₃ |
|
eptano |
ept |
C₇H₁₆ |
eptile |
C₇H₁₅ |
|
ottano |
Ottobre |
C₈H₁₈ |
ottil |
C₈H₁₇ |
|
nonane |
n on |
C₉H₂₀ |
nonil |
C₉H₁₉ |
|
decano |
destrano |
C₁₀H₂₂ |
decile |
C₁₀H₂₁ |
La suddetta nomenclatura di alcani comprende nomi che si sono sviluppati storicamente (i primi 4 membri di un certo numero di idrocarburi terminali).
I nomi di alcani non dispiegati con 5 o più atomi C sono formati da numeri greci che riflettono il dato numero di atomi C. Così il suffisso -an indica che la sostanza è da un numero di composti saturi. 
Quando vengono creati i nomi di alcani dispiegati, viene scelta la catena principale per contenere il numero massimo di atomi C. È numerata in modo che i sostituenti siano del numero più basso. Nel caso di due o più catene della stessa lunghezza, il principale è quello che contiene il maggior numero di sostituenti.
Isomeri di alcani
Come idrocarburi, il genitore della loro serie è il metano CH4. Con ogni rappresentante successivo della serie di metano, c'è una differenza rispetto alla precedente al gruppo metilenico – CH . Questa regolarità può essere tracciata in tutta la gamma di alcani.
Lo scienziato tedesco Schiel ha presentato una proposta per chiamare questa serie omologa. In greco, significa "simile, simile".
Così, la serie omologa è una serie di composti organici correlati aventi la stessa struttura con proprietà chimiche simili. Gli omologhi sono membri di questa serie. La differenza omologica è un gruppo di metilene, a cui si distinguono due omologhi vicini.
Come detto in precedenza, la composizione di qualsiasi idrocarburo saturo può essere espressa con la formula generale CnH2n + 2. Pertanto, il prossimo membro della serie omologa è metano-C2H следующим. Per dedurre la sua struttura dal metano, è necessario sostituire 1 atomo H con CH3 (figura sotto). 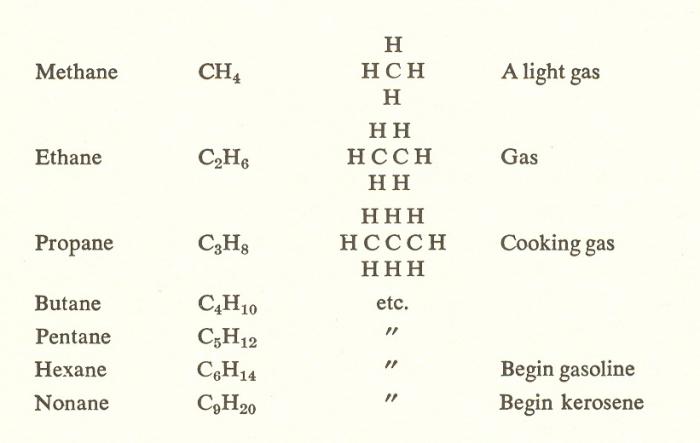
La struttura di ogni omologo successivo può essere dedotta dal precedente nello stesso modo. Di conseguenza, l'etano produce il propano-C3H8.
Quali sono gli isomeri?
Queste sono sostanze che hanno una identica composizione molecolare qualitativa e quantitativa (formula molecolare identica), ma struttura chimica diversa, oltre ad avere proprietà chimiche diverse.
Questi idrocarburi differiscono in un parametro del punto di ebollizione: -0,5 ° – butano, -10 ° – isobutano. Questo tipo di isomerismo è definito come l'isomerismo dello scheletro carbonaceo, si riferisce al tipo strutturale.
Il numero di isomeri strutturali cresce rapidamente con un aumento del numero di atomi di carbonio. Così, C0H22 corrisponderà a 75 isomeri (non compresi quelli spaziali) e per gli isomeri C15H322 4347 sono già noti, per C20H42 è 366 319.
Quindi, è diventato chiaro quali alchene, serie omologhe, isomerismo, nomenclatura. Ora è il momento di passare alle regole per la compilazione dei nomi per IUPAC. 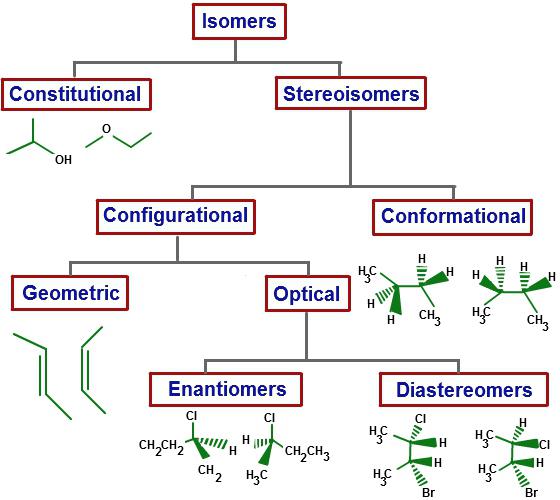
Nomenclatura IUPAC: regole per la formazione dei nomi
In primo luogo, è necessario trovare la catena del carbonio nella struttura idrocarburi, che è la più lunga e contiene il numero massimo di sostituenti. Quindi è necessario numerare gli atomi C della catena, a partire dalla fine del quale il sostituente è più vicino.
In secondo luogo, la base è il nome di un idrocarburo saturo non equilibrato, a cui la catena più importante corrisponde al numero di atomi C.
In terzo luogo, prima della base è necessario indicare il numero delle serrature vicino ai quali si trovano i sostituenti. Sono seguiti da un trattino con i nomi dei deputati.
In quarto luogo, nel caso della presenza di sostituenti identici per diversi atomi C, i blocchi si uniscono, prima del nome appare un attacco moltiplicatore: di – per due sostituenti identici, tre per tre, tetra-quattro, penta per cinque ecc. Dovrebbero essere separati l'uno dall'altro da una virgola, e dalle parole – da un trattino.
Se lo stesso atomo C contiene contemporaneamente due sostituenti, il lokant viene anche registrato due volte.
Secondo queste regole, si forma la nomenclatura internazionale di alcani. 
Proiezioni di Newman
Questo scienziato americano ha proposto formule speciali di proiezione – le proiezioni di Newman – per la dimostrazione grafica delle conformazioni. Corrispondono alle forme A e B e sono mostrate nella figura seguente. 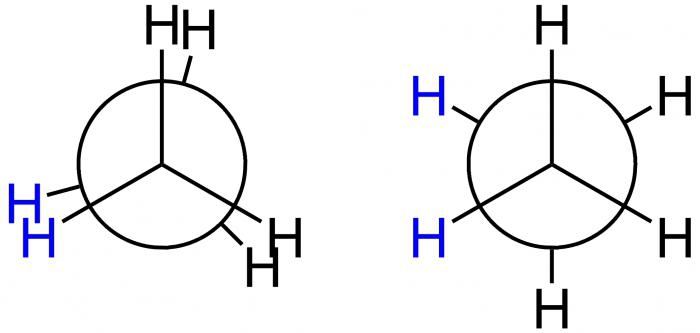
Nel primo caso, questa è una conformazione A-screened, mentre nel secondo caso è B-inibito. Nella posizione A, gli atomi H si trovano ad una distanza minima l'uno dall'altro. Questa forma corrisponde al più grande valore dell'energia, perché la repulsione tra di essi è la più grande. Questo è uno stato energeticamente sfavorevole, per cui la molecola tende a lasciarla e procedere ad una posizione più stabile B. Qui gli atomi H sono in una distanza massima l'una dall'altra. Pertanto, la differenza di energia di queste posizioni è di 12 kJ / mol, per cui la rotazione libera attorno all'asse della molecola di etano, che collega i gruppi metilici, viene ottenuta in modo non uniforme. Dopo essere caduto in una posizione energeticamente favorevole, la molecola è ritardata lì, in altre parole, "rallentato". Ecco perché è chiamato inibito. Il risultato – 10 mila molecole di etano sono in una forma di conformazione ostacolata in condizioni di temperatura ambiente. Solo uno ha una forma diversa – uno schermato.
Ottenere idrocarburi limitati
Dall'articolo è già divenuto noto che si tratta di alcani (la struttura, la cui nomenclatura è descritta dettagliatamente in precedenza). Sarà utile considerare i modi per ottenerli. Sono assegnati da fonti naturali come petrolio, gas naturale , gas associato, carbone. Sono anche utilizzati metodi sintetici. Ad esempio, H2 2H2:
- Il processo di idrogenazione degli idrocarburi insaturi: CnH2n (alcheni) → CnH2n + 2 (alchani) ← CnH2n-2 (alchini).
- Dalla miscela di gas di sintesi C e H: nCO + (2n + 1) H2 → CnH2n + 2 + nH2O.
- Degli acidi carbossilici (i loro sali): elettrolisi sull'anodo, sul catodo:
- Elettrolisi Kolbe: 2RCOONa + 2H20 → R-R + 2CO2 + H2 + 2NaOH;
- Reazione Dumas (lega con alcali): CH3COONa + NaOH (t) → CH4 + Na2CO .
- Cracking dell'olio: CnH2n + 2 (450-700 °) → CmH2m + 2 + Cn-mH2 (nm).
- Gasificazione del combustibile (solido): C + 2H2 → CH .
- Sintesi di alcani complessi (derivati alogenati) con meno C atomi: 2CH3Cl (clorometano) + 2Na → CH3-CH3 (etano) + 2NaCl.
- Decomposizione con acqua di metanidi (carburi di metalli): Al4C3 + 12H20 → 4Al (OH3) ↓ + 3CH4 ↑.
Proprietà fisiche degli idrocarburi ultimati
Per comodità, i dati vengono raggruppati in una tabella.
|
formula |
alcano |
Punto di fusione in ° C |
Punto di ebollizione in ° C |
Densità, g / ml |
|
CH ^ |
metano |
-183 |
-162 |
0,415 a t = -165 ° C |
|
C₂H₆ |
etano |
-183 |
-88 |
0,561 a t = -100 ° C |
|
C₃H₈ |
propano |
-188 |
-42 |
0,583 a t = -45 ° C |
|
n-C₄H₁₀ |
n-butano |
-139 |
-0.5 |
0,579 a t = 0 ° C |
|
2-metilpropano |
– 160 |
– 12 |
0,557 a t = -25 ° C |
|
|
2,2-dimetil-propano |
– 16 |
9.5 |
0613 |
|
|
n-C₅H₁₂ |
n-pentano |
-130 |
36 |
0,626 |
|
2-metilbutano |
– 160 |
28 |
0620 |
|
|
n-C₆H₁₄ |
n-esano |
– 95 |
69 |
0,660 |
|
2-metilpentano |
– 153 |
62 |
0.683 |
|
|
n-C₇H₁₆ |
n-Eptano |
– 91 |
98 |
0.683 |
|
n-C₈H₁₈ |
n-Octane |
– 57 |
126 |
0.702 |
|
2,2,3,3-tetra-metilbutano |
– 100 |
106 |
0656 |
|
|
2,2,4-trimetil-pentano |
– 107 |
99 |
0,692 |
|
|
n-C₉H₂₀ |
n-Nonano |
– 53 |
151 |
0718 |
|
n-C₁₀H₂₂ |
n-decano |
– 30 |
174 |
0.730 |
|
n-C₁₁H₂₄ |
n-undecano |
– 26 |
196 |
0.740 |
|
n-C₁₂H₂₆ |
n-Dodecane |
– 10 |
216 |
0,748 |
|
n-C₁₃H₂₈ |
n-tridecano |
– 5 |
235 |
0756 |
|
n-C₁₄H₃₀ |
n-tetradecano |
6 |
254 |
0,762 |
|
n-C₁₅H₃₂ |
n-pentadecano |
10 |
271 |
0,768 |
|
n-C₁₆H₃₄ |
n-esadecano |
18 |
287 |
0,776 |
|
n-C₂₀H₄₂ |
n-eicosano |
37 |
343 |
0,788 |
|
n-C₃₀H₆₂ |
n-Triakontan |
66 |
235 con 1 mm Hg. articolo |
0,779 |
|
n-C₄₀H₈₂ |
n-Tetrakontan |
81 |
260 con 3 mm Hg. Art. |
|
|
n-C₅₀H₁₀₂ |
n-Pentakontan |
92 |
a 420 15mmHg. Art. |
|
|
n-C₆₀H₁₂₂ |
n-Geksakontan |
99 |
||
|
n-C₇₀H₁₄₂ |
n-Geptakontan |
105 |
||
|
n-C₁₀₀H₂₀₂ |
n-Gektan |
115 |
conclusione
L'articolo è stato considerato una cosa come alcani (struttura, nomenclatura, isomeria, serie omologa e così via.). Ci dice un po 'le caratteristiche di radiali e di sostituzione nomenclature. I metodi sono descritti per l'ottenimento di alcani.
Inoltre, l'articolo elencato nel dettaglio tutta la nomenclatura di alcani (test può aiutare ad assimilare le informazioni).