enzimi biochimica. Struttura, proprietà e funzioni
La cellula di ogni organismo vivente, milioni di reazioni chimiche avvengono. Ciascuno di essi è importante, quindi è importante mantenere la velocità dei processi biologici ad alto livello. Quasi ogni reazione è catalizzata da suo enzima. Cosa sono gli enzimi? Qual è il loro ruolo in una gabbia?
Enzimi. definizione
Il termine "enzima" deriva dal latino fermentum – lievito. Essi possono anche essere chiamati enzimi dal greco en zyme – "a passi da gigante."
Enzimi – sostanze biologicamente attive, in modo che qualsiasi reazione nella cella, non possono fare a meno. Questi composti agiscono come catalizzatori. Di conseguenza, qualsiasi enzima ha due proprietà principali:
1) Enzima accelera la reazione biochimica, ma non si consuma.
2) Il valore della costante di equilibrio non cambia, ma accelera solo il raggiungimento di questo valore.
Gli enzimi accelerano le reazioni biochimiche in migliaia, e in alcuni casi, un milione di volte. Ciò significa che, in assenza del sistema enzimatico tutti i processi intracellulari è praticamente cessato, e la cellula stessa muore. Pertanto, il ruolo degli enzimi come ingredienti attivi è alto.
Una varietà di enzimi consente di diversificare regolare il metabolismo cellulare. In ogni cascata di reazioni che hanno partecipato molte classi differenti di enzimi. catalizzatori biologici hanno una elevata selettività attraverso una specifica conformazione della molecola. T. A. Nella maggior parte dei casi gli enzimi sono proteine in natura, sono in struttura terziaria o quaternaria. Il motivo è ancora una volta la specificità della molecola. 
La funzione degli enzimi nella cellula
Il compito principale dell'enzima – accelerazione reazione corrispondente. Eventuali processi cascata, poiché la decomposizione del perossido di idrogeno e glicolisi termina, richiede la presenza di un catalizzatore biologico.
Il corretto funzionamento del enzimi raggiunto elevata specificità ad un substrato specifico. Ciò significa che il catalizzatore può solo accelerare determinata reazione e non più, anche molto simile. Con il grado di specificità dell'enzima, il gruppo seguente:
1) Gli enzimi con specificità assoluta quando catalizzata da solo un'unica reazione. Ad esempio, collagenasi digerisce il collagene, e si unirà maltase maltosio.
2) enzimi con relativa specificità. Questo include sostanze che possono catalizzare una certa classe di reazioni, per esempio, la scissione idrolitica.
lavoro biocatalizzatore inizia con il collegamento del suo sito attivo al substrato. Allo stesso tempo, parlare della interazione complementare simile ad una serratura e chiave. Questo si riferisce ad una corrispondenza completa con il substrato costituisce il centro attivo, che permette di accelerare la reazione.
Il passo successivo consiste nel corso della reazione. La sua velocità aumenta l'azione del complesso enzimatico. Alla fine, otteniamo l'enzima, che è associato con i prodotti di reazione.
fase finale – per rimuovere i prodotti di reazione dalla enzima, dopo di che il sito attivo diventa di nuovo libero per un'altra operazione.
Schematicamente, il lavoro dell'enzima in ogni fase può essere scritta come:
1) S + E -> SE
2) SE -> SP
3) SP -> S + P, dove S – è il substrato, e – l'enzima, e P – prodotto. 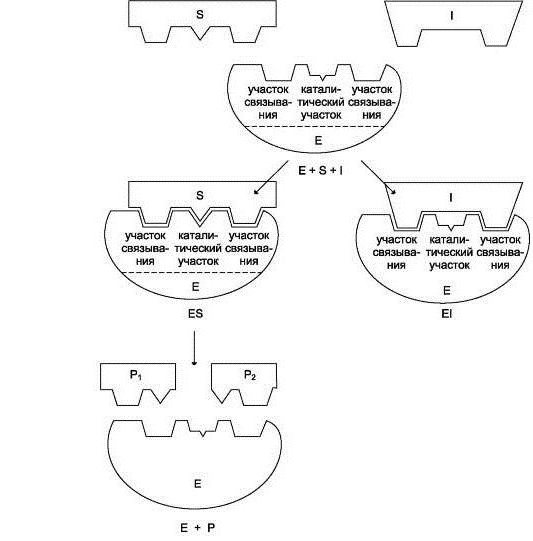
Classificazione degli enzimi
Nel corpo umano, è possibile trovare un gran numero di enzimi. Tutta la conoscenza circa le loro funzioni e il lavoro sono stati sistematizzata, e di conseguenza c'è stata una classificazione comune, attraverso il quale si può facilmente determinare ciò che è un particolare catalizzatore. Qui ci sono sei classi di base di enzimi, così come alcuni esempi di sottogruppi.
- Ossidoreduttasi.
Gli enzimi di questa classe catalizzano reazioni di ossidoriduzione. Totale recuperato 17 sottogruppi. Ossidoriduttasi sono solitamente non proteico porzione provvista vitamina o eme.
Tra le ossidoreduttasi sono spesso trovato le seguenti sottogruppi:
a) deidrogenasi. enzima biochimica-deidrogenasi è cleaving atomi di idrogeno e di trasferimento a un altro substrato. Questo sottogruppo è più comune nelle reazioni della respirazione, la fotosintesi. Come parte della deidrogenasi è necessariamente presente nella forma di coenzima NAD / NADH o flavoproteins FAD / FMN. Spesso ci sono ioni metallici. Esempi includono enzimi come tsitohromreduktazy, piruvato deidrogenasi, isocitrato deidrogenasi, e anche molti enzimi epatici (lattato deidrogenasi, glutammato deidrogenasi, e così via. D.).
b) ossidasi. Un certo numero di enzimi catalizzano l'aggiunta di ossigeno e idrogeno, per cui i prodotti di reazione possono essere acqua o acqua ossigenata (H 2 0, H 2 0 2). Esempi di enzimi citocromo ossidasi, tirosinasi.
c) perossidasi e catalasi – enzimi che catalizzano la decomposizione H 2 O 2 in acqua e ossigeno.
g) ossigenasi. Questi biocatalizzatori accelerano attaccamento ossigeno al substrato. Dofamingidroksilaza – uno degli esempi di tali enzimi.
2. Transferasi.
enzimi bersaglio di questo gruppo è trasferimento di radicali dalla sostanza della sostanza donatore al ricevente.
a) metiltransferasi. DNA metiltransferasi – enzimi chiave che controllano il processo di replicazione del DNA. nucleotidi metilazione svolge un ruolo importante nella regolazione del lavoro degli acidi nucleici.
b) aciltransferasi. Gli enzimi di questo sottogruppo vengono trasportati da una molecola ad un altro gruppo acile. Esempi aciltransferasi: lecitina-colesterolo aciltransferasi (porta gruppo funzionale con un acido grasso sul colesterolo), lizofosfatidilholinatsiltransferaza (gruppo acile viene trasferita lisofosfatidilcolina).
c) aminotransferasi – enzimi che sono coinvolti nella conversione di aminoacidi. Esempi del enzimi alanina aminotransferasi che catalizza la sintesi di alanina dal piruvato e glutammato trasferendo un gruppo ammino.
g) fosfotransferasi. Enzimi catalizzano l'aggiunta di questo sottogruppo del gruppo fosfato. Un altro nome phosphotransferase chinasi, è più comune. Esempi includono enzimi quali esochinasi e aspartato, che sono attaccati ai residui di esoso fosfati (principalmente glucosio) e acido aspartico , rispettivamente.
3. idrolasi – una classe di enzimi che catalizzano la rottura di legami nella molecola, seguito da aggiunta di acqua. Le sostanze che appartengono a questo gruppo – il principale enzima digestivo.
a) esterasi – rompere i legami esterei. Esempio – lipasi che abbattere i grassi.
b) glicosidasi. enzimi Biochimica di questa serie sta nella distruzione dei legami glicosidici di polimeri (oligosaccaridi e polisaccaridi). Esempi: amilasi, saccarasi, maltasi.
c) peptidasi – enzimi che catalizzano la ripartizione delle proteine in aminoacidi. enzimi peptidasi-correlati, come pepsina, tripsina, chimotripsina, karboiksipeptidaza.
g) amidasi – legami ammidici fendi. Esempi: .. Arginase, ureasi, glutaminase ecc Molti amidasi enzimi si trovano in ciclo ornitina.
4. liasi – enzimi per funzioni simili a idrolasi, tuttavia nella rottura di legami in molecole non consumati acqua. Enzimi di questa classe hanno sempre una parte della porzione non proteico, ad esempio, sotto forma di vitamine B1 e B6.
a) decarbossilasi. Questi enzimi agiscono sul legame C-C. Esempi sono acido glutammico decarbossilasi o piruvato decarbossilasi.
b) idratasi e deidratasi – enzimi che catalizzano la rottura di legami C-O.
c) I ammidinici-lyases – distruggendo legame C-N. Esempio: argininsuktsinatliaza.
g) R-O liasi. Tali enzimi sono solitamente spaccati un gruppo fosfato da un materiale di substrato. ESEMPIO: adenilato ciclasi. 
Biochimica di enzimi base alla loro struttura
La capacità di ciascun enzima viene determinato dalla singola, solo la sua struttura intrinseca. Qualsiasi enzima – è in primo luogo di proteine, e la sua struttura e il grado di ripiegamento svolgono un ruolo cruciale nel determinare la sua funzione.
Ogni biocatalizzatore è caratterizzata dalla presenza del centro attivo, che, a sua volta, viene suddiviso in diverse aree funzionali:
1) catalitica Centro – una regione speciale della proteina, in cui l'enzima adesione al substrato. A seconda della conformazione del centro catalitico molecola proteica può assumere una varietà di forme, che dovrebbe corrispondere al substrato così come una serratura e chiave. Tale struttura complessa spiega perché la proteina enzimatica è nello stato terziario o quaternario.
2) adsorbimento Centro – funge da "supporto". Qui, prima di tutto comunicazione avviene tra la molecola enzimatica e la molecola di substrato. Tuttavia, la connessione che forma il centro di adsorbimento, molto debole, e quindi la reazione catalitica è reversibile in questa fase.
3) centri allosterici possono essere situati nel centro attivo, e tutta la superficie dell'enzima. La loro funzione – regolazione dell'enzima. Il regolamento avviene tramite molecole inibitori ed attivatori molecole.
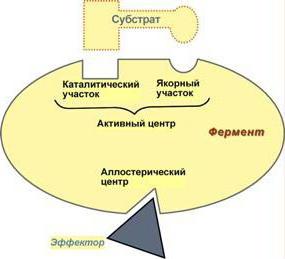
Le proteine attivatore di legame alla molecola enzimatica, accelerare il suo funzionamento. Inibitori, al contrario, inibiscono l'attività catalitica, e questo può avvenire in due modi: o la molecola si lega alla regione centro allosterico del centro attivo dell'enzima (inibizione competitiva) o è fissata ad un'altra regione della proteina (inibitore non competitivo). inibizione competitiva è considerato più efficace. Dopo così spazio chiuso per substrato obbligatorio all'enzima, e questo processo è possibile solo nel caso di praticamente completa coincidenza della molecola inibitore e formano un centro attivo.
Enzima spesso non consiste di aminoacidi, ma anche di altre sostanze organiche e inorganiche. Di conseguenza, isolato apoenzyme – proteici porzione coenzima – parte organica e cofattore – parte inorganica. Coenzima può essere rappresentato ulgevodami, grassi, acidi nucleici, vitamine. A sua volta, il cofattore – è spesso un sostegno ioni metallici. attività enzimatica è determinata dalla sua struttura: sostanze addizionali inclusi nella composizione, alterare le proprietà catalitiche. Vari tipi di enzimi – è il risultato di una combinazione di tutti questi fattori formano un complesso. 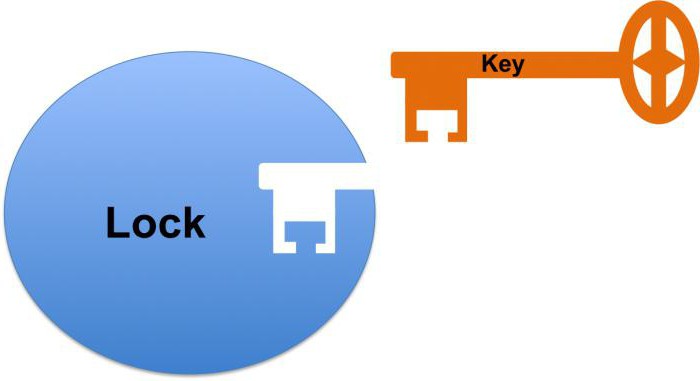
Regolamento del lavoro di enzimi
Enzimi come la sostanza biologicamente attiva non è sempre necessaria per il corpo. Biochimica degli enzimi è che possono, nel caso di cellule viventi eccessiva catalisi danno. Per evitare effetti nocivi sul enzimi necessari al corpo di regolare in qualche modo il loro lavoro.
T. A. Gli enzimi sono proteine in natura, sono facilmente distrutti ad alte temperature. processo denaturazione è reversibile, ma può influenzare significativamente la sostanza.
pH svolge anche un ruolo importante nella regolazione. Massima attività enzimatica è generalmente osservata a pH neutro (7,0-7,2). Ha anche enzimi che funzionano solo in condizioni acide o alcaline solo. Così, nei lisosomi cellulari mantenuto basso pH, in cui la massima attività di enzimi idrolitici. In caso di contatto accidentale con il citoplasma, dove l'ambiente è più vicino alla neutralità, la loro attività diminuirà. Tale protezione da "samopoedaniya" si basa sulle caratteristiche del idrolasi.
Vale la pena ricordare l'importanza del coenzima e cofattore nella composizione di enzimi. La presenza di vitamine o ioni metallici influenza significativamente il funzionamento di alcuni enzimi specifici. 
Nomenclatura degli enzimi
Tutti gli enzimi del corpo sono chiamati secondo la loro appartenenza a una qualsiasi delle classi, così come il supporto con cui reagiscono. A volte la nomenclatura sistematica utilizzato non uno ma due del substrato nel titolo.
Esempi di nomi di alcuni enzimi:
- enzimi epatici: lattato degidrogen aza-glutammato-aza-degidrogen.
- Nome completo sistematica dell'enzima: lattato + NAD -oksidoredukt-aza.
nomi conservati e banali, che non rispettano le regole della nomenclatura. Esempi sono enzimi digestivi: tripsina, chimotripsina, pepsina.
Il processo di sintesi di enzimi
Le funzioni degli enzimi sono determinati anche a livello genetico. Dal momento che la molecola è in gran -. Proteine, e la sua sintesi è esattamente lo stesso che i processi di trascrizione e traduzione.
enzimi sintesi avviene come segue. Inizialmente, DNA leggere le informazioni circa l'enzima desiderato per formare mRNA. RNA messaggero codifica tutti gli aminoacidi che fanno parte dell'enzima. Regolamentazione degli enzimi può verificarsi anche a livello del DNA, se il prodotto della reazione catalizzata abbastanza ferma trascrizione genica e, al contrario, se v'è una necessità nel prodotto, si attiva il processo di trascrizione.
Una volta che l'mRNA è stato rilasciato nel citoplasma, la fase successiva – la trasmissione. Sui ribosomi reticolo endoplasmatico sintetizzato catena primaria costituito da amminoacidi legati da legami peptidici. Tuttavia, la molecola proteica nella struttura primaria non può ancora svolgere la sua funzione enzimatica.
L'attività enzimatica dipende strutture proteiche. proteine stesse EPS verifica torsione, formando così prima struttura secondaria e terziaria poi. La sintesi di alcuni enzimi è fermo in questa fase, ma che permettono di migliorare l'attività del catalizzatore è spesso necessario attaccamento e cofattore coenzima.
In alcune aree del reticolo endoplasmatico viene attaccato componenti organici dell'enzima: zuccheri, acidi nucleici, grassi e vitamine. Alcuni enzimi non può funzionare senza la presenza del coenzima.
Cofattore gioca un ruolo cruciale nella formazione della struttura quaternaria della proteina. Alcune delle funzioni degli enzimi sono disponibili solo quando l'organizzazione del dominio della proteina. Pertanto è molto importante per la loro struttura quaternaria presenza in cui una biella tra più globuli proteina è uno ione metallico. 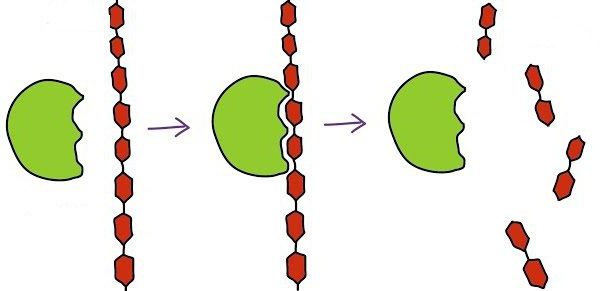
Molteplici forme di enzimi
Ci sono situazioni in cui è necessaria la presenza di numerosi enzimi che catalizzano la stessa reazione, ma differiscono tra loro in alcuni aspetti. Ad esempio, l'enzima può funzionare a 20 gradi, ma a 0 gradi, non sarà in grado di svolgere le sue funzioni. Cosa fare in una situazione del genere, il corpo vivente a basse temperature?
Questo problema è facilmente risolto dalla presenza di numerosi enzimi che catalizzano la stessa reazione, ma in diverse condizioni di lavoro. Ci sono due tipi di molteplici forme di enzimi:
- Isoenzimi. Tali proteine sono codificati da geni diversi, sono composti da aminoacidi diversi, ma catalizzano la stessa reazione.
- forme più vero. Queste proteine sono trascritti dallo stesso gene, bensì si verifichi peptidi ribosomi modifica. All'uscita prodotto diverse forme dello stesso enzima.
Come risultato, molteplici forme del primo tipo è formata a livello genetico, quando la seconda – il post-traduzionale.
Significato enzimi
L'uso di enzimi in medicina si riduce alla questione dei nuovi farmaci, nell'ambito del quale le sostanze sono già nelle giuste quantità. Gli scienziati non hanno ancora trovato un modo per stimolare la sintesi di enzimi mancanti nel corpo, ma è ora ampiamente farmaci che possono fare per tutta la durata del loro svantaggio distribuito.
Vari enzimi in una cella per catalizzare molte reazioni relativi alla manutenzione della vita. Uno di questi rappresentanti sono enizmov nucleasi gruppo: endonucleasi e esonucleasi. Il loro lavoro è quello di mantenere un livello costante di acidi nucleici in una cella, la rimozione di DNA e RNA danneggiato.
Non dimenticare il fenomeno della coagulazione del sangue. Come misura efficace di protezione, il processo è controllato da un certo numero di enzimi. Capo fra loro è trombina che converte il fibrinogeno in fibrina proteina inattiva attiva. Il suo filo crea una sorta di rete che occlude il luogo di ferita nave, impedendo in tal modo la perdita di sangue eccessiva.
Gli enzimi sono utilizzati nella vinificazione, fermentazione, la produzione di molti prodotti lattiero-caseari. Per l'alcol dal lievito glucosio può essere utilizzato, tuttavia, per il verificarsi di successo di questo processo ed estrarre abbastanza di loro. 
Numeri interessanti di cui non sapevano
– Tutti gli enzimi del corpo hanno una massa enorme – 5.000 a 1.000.000 Da. Ciò è dovuto alla presenza di proteine nella molecola. Per confronto, il peso molecolare del glucosio – 180 Sì, e anidride carbonica – un totale di 44 Sì.
– Fino ad oggi, ha aperto più di 2000 enzimi che si trovano nelle cellule di vari organismi. Tuttavia, la maggior parte di queste sostanze sono ancora pienamente compreso.
– attività enzimatica viene utilizzato per ottenere detersivi efficaci. Qui, gli enzimi svolgono lo stesso ruolo nel corpo: abbattere la materia organica, e questa proprietà aiuta a macchie di combattimento. Si consiglia di utilizzare tale detersivo ad una temperatura non superiore a 50 gradi, altrimenti può andare al processo denaturazione.
– Secondo le statistiche, il 20% delle persone nel mondo soffrono la mancanza di qualsiasi degli enzimi.
– Circa le proprietà di enzimi noti per molto tempo, ma solo nel 1897, la gente ha capito che non è il lievito, e un estratto dal loro cellule possono essere utilizzate per la fermentazione degli zuccheri in alcool.











