L'ammoniaca è un antipodo e analogico … di acqua?
L'odore di questo gas è noto a tutti – si può sentire subito se si apre il vaso con ammoniaca. Qualcosa sulle sue proprietà ci è stato detto a scuola. È anche noto che è uno dei prodotti chiave dell'industria chimica: è più facile trasformare l'azoto, il che non piace quindi ad entrare in reazioni chimiche. L'ammoniaca è il primo punto da cui inizia la produzione di molti composti contenenti azoto: vari nitriti e nitrati, esplosivi e coloranti anilina, farmaci e materiali polimerici …
Brevi informazioni
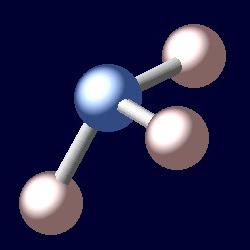 Il nome di questa sostanza deriva dal greco "hals ammoniakos", che in traduzione significa ammoniaca. La molecola di ammoniaca è una specie di piramide, alla cui parte superiore c'è un atomo di azoto, e alla base – tre atomi di idrogeno. La formula per questo composto è NH3. In condizioni normali, l'ammoniaca è un gas incolore con odore asfittante e pungente. La sua densità a -33,35 ° C (punto di ebollizione) è 0,681 g / cm 3 . E questa sostanza si scioglie a -77.7 ° С. La massa molare di ammoniaca è di 17 grammi per mole. La pressione di 0,9 MPa causa l'ammoniaca a contrattare a temperatura ambiente. Viene prodotto nell'industria sotto pressione dalla sintesi catalitica dall'idrogeno e dall'ossigeno. L' ammoniaca liquida è un fertilizzante altamente concentrato, un refrigerante. Si consiglia di prendersi cura di questa sostanza, perché è tossica ed esplosiva.
Il nome di questa sostanza deriva dal greco "hals ammoniakos", che in traduzione significa ammoniaca. La molecola di ammoniaca è una specie di piramide, alla cui parte superiore c'è un atomo di azoto, e alla base – tre atomi di idrogeno. La formula per questo composto è NH3. In condizioni normali, l'ammoniaca è un gas incolore con odore asfittante e pungente. La sua densità a -33,35 ° C (punto di ebollizione) è 0,681 g / cm 3 . E questa sostanza si scioglie a -77.7 ° С. La massa molare di ammoniaca è di 17 grammi per mole. La pressione di 0,9 MPa causa l'ammoniaca a contrattare a temperatura ambiente. Viene prodotto nell'industria sotto pressione dalla sintesi catalitica dall'idrogeno e dall'ossigeno. L' ammoniaca liquida è un fertilizzante altamente concentrato, un refrigerante. Si consiglia di prendersi cura di questa sostanza, perché è tossica ed esplosiva.
Fatti curiosi
L'ammoniaca liquida ha proprietà piuttosto insolite. All'esterno assomiglia all'acqua semplice. Come H 2 O, esso scioglie perfettamente molti composti organici e inorganici. La maggior parte dei sali in esso si dissociano quando sciolto in ioni. Allo stesso tempo, le reazioni chimiche, in contrasto con l'acqua, si verificano in modo piuttosto diverso.
|
ZnCl 2 |
BaCl2 |
KCl |
NaCl |
KI |
Ba (NO3) 2 |
Agi |
||
|
Solubilità a 20 ° C, basata su 100 g di solvente |
ammoniaca |
0 |
0 |
0.04 |
3 |
182 |
97 |
207 |
|
acqua |
367 |
36 |
34 |
36 |
144 |
9 |
0 |
|
I dati in questa tabella portano all'idea che l'ammoniaca liquida sia un mezzo unico per effettuare alcune reazioni di scambio che sono praticamente inoperabili in soluzioni acquose.  Ad esempio:
Ad esempio:
2AgCl + Ba (NO 3 ) 2 = 2AgNO 3 + BaCl 2 .
Poiché NH 3 è un acuto accetto protonico, l'acido acetico, nonostante il fatto che sia considerato debole, dissocierà completamente, proprio come gli acidi forti fanno. Di maggiore interesse sono soluzioni in alcool ammoniaca di metalli alcalini. Già nel 1864, i chimici notarono che se avessero dato tempo, l'ammoniaca sarebbe evaporata e nel sedimento sarebbe un metallo puro. Quasi la stessa cosa avviene con soluzioni acquose di sali. La differenza è che i metalli alcalini, anche se in piccola quantità, ma ancora reagiscono con l'ammoniaca, con conseguente formazione di amidi di sale:
2Na + 2NH3 = 2NaNH2 + H2.
Questi ultimi sono sostanze abbastanza stabili, ma quando entrano in contatto con l'acqua si disintegrano immediatamente:
NaNH2 + H20 = NH3 + NaOH.
 Studiando le proprietà dell'ammoniaca liquida, i chimici hanno richiamato l'attenzione sul fatto che quando il metallo viene sciolto, il volume della soluzione diventa più grande. Inoltre, la sua densità diminuisce con questo. Questa è un'altra differenza tra il solvente in questione e l'acqua ordinaria. È difficile credere, ma la soluzione concentrata e diluita di qualsiasi metallo alcalino in ammoniaca liquida non si mescola, nonostante il metallo in entrambi è lo stesso! Grazie agli esperimenti, i fatti nuovi e sorprendenti vengono costantemente scoperti. Così si è scoperto che la soluzione di sodio congelata in ammoniaca liquida ha una scarsa resistenza e pertanto NH3 può essere utilizzato per produrre un sistema di superconduttori. Non sorprende che questo gas e le sue soluzioni siano ancora di interesse per le menti di fisici e chimici.
Studiando le proprietà dell'ammoniaca liquida, i chimici hanno richiamato l'attenzione sul fatto che quando il metallo viene sciolto, il volume della soluzione diventa più grande. Inoltre, la sua densità diminuisce con questo. Questa è un'altra differenza tra il solvente in questione e l'acqua ordinaria. È difficile credere, ma la soluzione concentrata e diluita di qualsiasi metallo alcalino in ammoniaca liquida non si mescola, nonostante il metallo in entrambi è lo stesso! Grazie agli esperimenti, i fatti nuovi e sorprendenti vengono costantemente scoperti. Così si è scoperto che la soluzione di sodio congelata in ammoniaca liquida ha una scarsa resistenza e pertanto NH3 può essere utilizzato per produrre un sistema di superconduttori. Non sorprende che questo gas e le sue soluzioni siano ancora di interesse per le menti di fisici e chimici.