soluzioni elettrolitiche
soluzioni elettrolitiche sono liquidi speciali che sono parzialmente o completamente sotto forma di particelle cariche (ioni). Lo stesso processo di scissione delle molecole sulla negativamente (anioni) e (cationi) cariche positivamente particelle chiamate dissociazione elettrolitica. Dissociazione in soluzione è possibile grazie alla capacità degli ioni di interagire con le molecole del liquido polare che agisce come solvente.
Quali sono gli elettroliti
 soluzioni elettrolitiche sono suddivisi in acquose e non acquose. L'acqua ha studiato abbastanza bene ed erano molto diffusi. Sono in quasi ogni organismo vivente ed è attivamente coinvolto in molti processi biologici importanti. elettroliti non acquosi sono validi per processi elettrochimici e una varietà di reazioni chimiche. Il loro uso ha portato all'invenzione di nuove fonti di energia chimica. Essi svolgono un ruolo importante nelle cellule fotoelettrochimiche, sintesi organica, condensatori elettrolitici.
soluzioni elettrolitiche sono suddivisi in acquose e non acquose. L'acqua ha studiato abbastanza bene ed erano molto diffusi. Sono in quasi ogni organismo vivente ed è attivamente coinvolto in molti processi biologici importanti. elettroliti non acquosi sono validi per processi elettrochimici e una varietà di reazioni chimiche. Il loro uso ha portato all'invenzione di nuove fonti di energia chimica. Essi svolgono un ruolo importante nelle cellule fotoelettrochimiche, sintesi organica, condensatori elettrolitici.
soluzioni elettrolitiche, a seconda del grado di dissociazione possono essere suddivisi in forte, medio e debole. grado di dissociazione (α) – è il rapporto delle molecole rotti nei particelle cariche al numero totale di molecole. In elettroliti forti valore alfa vicino a 1, al α≈0,3 centrale, e la α debole <0,1.
In generale, gli elettroliti forti includono sali, diversi di alcuni acidi – HCl, HBr, HI, HNO 3, H 2 SO 4, HClO 4, idrossidi di bario, stronzio, calcio e metalli alcalini. Altra base e acido – media elettrolita o forza debole.
soluzioni elettrolitiche Properties
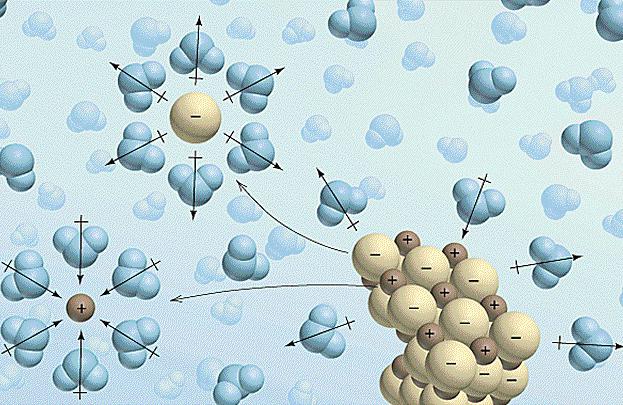 Le soluzioni di formazione sono spesso accompagnati da effetti termici e variazioni di volume. Il processo di dissoluzione elettrolita nel liquido avviene in tre fasi:
Le soluzioni di formazione sono spesso accompagnati da effetti termici e variazioni di volume. Il processo di dissoluzione elettrolita nel liquido avviene in tre fasi:
- La distruzione di legami chimici e elettrolito intermolecolare disciolto richiede costi di una certa quantità di energia e quindi l'assorbimento di calore si verifica (bit? H> 0).
- In questa fase, il solvente inizia ad interagire con gli ioni elettrolitici, causando la formazione di solvati (in soluzione acquosa – idrati). Questo processo è noto ed è esotermica solvatazione, cioè esotermico verifica (Δ H idr <0).
- L'ultima tappa – la diffusione. Questa distribuzione uniforme di idrati (solvati) nella soluzione in massa. Questo processo richiede la spesa di energia e quindi la soluzione viene raffreddata (differenziale? H> 0).
Pertanto, l'effetto termico totale di dissolvere l'elettrolita può essere scritto nella seguente forma:
Sol? H = H +? H scarico idraulico differenziale? H +
Da questo, quali sarebbero i componenti degli effetti di energia dipende dal voto finale del calore totale di scioglimento degli effetti elettrolita. Di solito questo processo è endotermico.
 Proprietà della soluzione dipende principalmente sulla natura dei suoi elementi costitutivi. Inoltre, le proprietà della composizione soluzione elettrolitica è influenzato, pressione e temperatura.
Proprietà della soluzione dipende principalmente sulla natura dei suoi elementi costitutivi. Inoltre, le proprietà della composizione soluzione elettrolitica è influenzato, pressione e temperatura.
A seconda del contenuto di tutte le soluzioni soluto elettrolita può essere diviso in molto diluito (in cui contiene un'unica "tracce" elettrolitici), diluite (contenente una piccola quantità di soluto) e concentrata (con un significativo contenuto elettrolita).
reazioni chimiche in soluzioni elettrolitiche, che sono causati dal passaggio di corrente elettrica porta all'isolamento di alcuni materiali per gli elettrodi. Questo fenomeno si chiama elettrolisi ed è spesso usato nell'industria moderna. In particolare, a causa dell'elettrolisi ottenuto alluminio, idrogeno, cloro, idrossido di sodio, perossido di idrogeno, e molte altre sostanze importanti.













