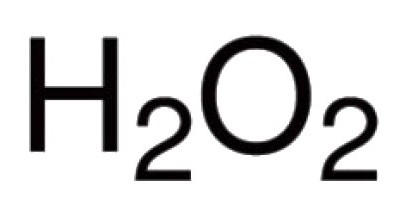Qual è la valenza di ossigeno nei composti?
Al fine di determinare l'eventuale ossigeno valori valenza dovrebbe esaminare la situazione dell'elemento nella tavola periodica, le caratteristiche principali della struttura dei suoi atomi. Questo approccio è utile nello studio della questione di ciò che la valenza di ossigeno nel tipico e ciò che non è tipico per lui. I composti più comuni presentano normale valenza – II. Questa caratteristica consente di definire il numero di legami di un altro atomo nelle formule binari finiti coinvolgono ossigeno.
Qual è la valenza di ossigeno?
Nella fase iniziale di accumulazione della conoscenza delle proprietà e struttura delle sostanze chimici pensato che la valenza – la possibilità di associare un determinato numero di atomi in una molecola della sostanza. Molti scienziati dopo la scoperta dell'elemento hanno cercato di capire quale sia la valenza di ossigeno. La risposta è stata ottenuta tramite esperimento: ossigeno attacca due monovalente atomo di idrogeno in una reazione chimica, significa bivalente. Rappresentazioni di vario legame chimico con l'accumulo di conoscenze sulla struttura delle sostanze. Nella sua teoria della valenza di H. Lewis e W. Kossel indicare la natura della interazione chimica con il punto di vista struttura elettronica. I ricercatori spiegano la capacità del atomo per formare un certo numero di connessioni lotta per lo stato di energia più stabile. Nel caso di conseguire la più piccola delle particelle della sostanza diventa più stabile. In teoria e strutture di Lewis molta attenzione prestata al ruolo degli elettroni esterni che partecipano alla creazione di un legame chimico.
Proprietà di posizionamento ossigeno della tavola periodica
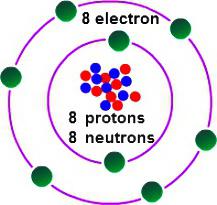
Al fine di stabilire quali abbiano la valenza di ossigeno, è necessario considerare alcune caratteristiche della sua struttura elettronica. capo gruppo ossigeno 16 della tavola periodica. Il nome comune dei membri della famiglia – "calcogeni" della classificazione obsoleti a cui appartengono VI gruppo (A). Nella tavola periodica di ossigeno è in una cella sotto №8. Il nucleo contiene nella sua composizione 8 e lo stesso numero di particelle elementari neutre positive. Nello spazio di un atomo, ci sono due livelli di energia che si verificano quando gli elettroni 8, 6 dei quali – esterno.

Che rapporto esiste tra la composizione dell'atomo e la valenza?
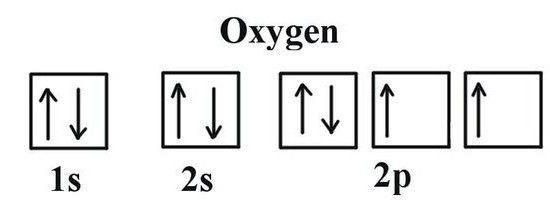
All'ultimo livello dell'atomo di ossigeno contiene due elettroni spaiati. L'elemento fluoro è inferiore al valore del elettronegatività (capacità di attrarre elettroni di legame pair). Nella formazione dei composti con altri elementi ossigeno attrae sorto nella molecola una densità elettronica totale (tranne elettroni fluoro). Raggiungere uno stato stazionario del guscio esterno eventualmente con l'aggiunta di due cariche negative. Ciò significa che l'ossigeno è richiesto 2 elettroni. Possibili seguenti opzioni: accettare un elettrone (valenza II), lontano dalle altre atomo 2 elettroni (valenza II), non accetta elettroni da altri atomi (0 valenza). comportamento tipico ossigeno caratterizza il secondo caso. In questo modo è possibile utilizzare per scoprire che cosa la valenza di ossigeno nel più tipico nei suoi composti comuni. Questi includono una maggioranza di ossidi di metalli e non metalli.
Come fa una valenza nei composti?
L'ossigeno è in grado di interagire direttamente con molti degli elementi chimici. Conosciuta suoi composti con praticamente tutti i rappresentanti della tavola periodica (ad eccezione del gas inerti argon, elio, neon). La reazione con alogeni e metalli nobili, ossigeno non può impegnarsi direttamente, ma ossidi Au 2 O 3, F 2 O, Cl 2 O 7 e altri esistere (indirettamente ottenuta). Per composti binari nella formazione di ossigeno quali partecipa, caratterizzato da un legame covalente e polarità. Valency in tali molecole dipende dal numero di eventuali coppie di elettroni, che sono attratti al nucleo di atomi diversi. Nella grande maggioranza dei composti degli atomi di ossigeno sono coinvolti nella creazione di due legami covalenti. Ad esempio, in ossidi di CO 2, P 2 O 5, SO 2, SO 3, K 2 O, B 2 O 3, Mo 2 O 5, e altre molecole. I reperti hydronium catione H 3 O + ossigeno atipici per lui valency III. La presenza di perosso -OO- causato natura insolita di perossido di idrogeno H 2 O 2. Questo composto presenta una caratteristica ossigeno esso valenza II.
Come determinare la valenza degli elementi?
Il concetto di ossigeno valenza offre possibilità Lewis struttura – elemento simbolo chimico attorno al quale elettroni punti indicano lo strato esterno. Prendono parte alla creazione di molecole che fanno parte delle coppie di elettroni condivisi. Formula Lewis dimostra valenza ossigeno corrispondente al numero dei suoi elettroni spaiati (2). Lo stesso risultato è stato ottenuto utilizzando strutture di immagine elettronici. Le due celle degli elettroni spaiati situati livello di ossigeno esterno (indicate dalle frecce nella formula). Per informazioni su ciò che la valenza di ossigeno, permettendo alla formula finale per il valore di un composto binario di atomi vicini. Per fare questo, eseguire semplici calcoli. Viene prima moltiplicato per il numero di atomi di O al tasso normale per la valenza ossigeno. Il valore risultante deve essere diviso per l'indice come specificato nella formula del simbolo chimico vicino a un altro elemento a combinarsi con l'ossigeno. Con un metodo semplice calcoliamo il carbonio e fosforo nei valenza loro ossidi.
- Moltiplicare l'indice in basso a destra del biossido segno O in tipico elemento valenza CO 2 2 • 2 = 4. Il numero risultante dividere indice specificata per il carbonio: 4/1 = 4. L'anidride carbonica CO 2 è nel suo alto stato di valenza IV .
- Indice basso a destra del simbolo chimico di ossigeno in ossido di fosforo P 2 O 5 moltiplicare il tipico valenza dell'atomo O 5 • 2 = 10. Questo numero dividere per detta formula nell'indice in basso a destra degli atomi di fosforo: 10/2 = 5. L'ossido di fosforo è al massimo V. valenza