Gli elettroni – che cosa è questo? Le proprietà e la storia della scoperta degli elettroni
Tutto intorno a noi il mondo è fatto di piccole, impercettibili all'occhio delle particelle. Gli elettroni – questo è uno di loro. La loro scoperta è verificato in tempi relativamente recenti. E ha aperto una nuova comprensione della struttura dell'atomo, meccanismi di trasmissione di energia elettrica e la struttura del mondo nel suo complesso.
Come dividere l'indivisibile
La moderna comprensione degli elettroni – questo particelle elementari. Essi sono coerenti e non divisi in strutture più piccole. Ma una tale idea non è sempre esistita. Fino al 1897 circa elettroni non avevano idea.
Altri pensatori dell'antica Grecia indovinato che ogni elemento sulla luce, l'edificio è costituito da una pluralità di "mattoni" microscopici. La più piccola unità di materia, allora considerato l'atomo, e questa convinzione persiste per secoli.
Rappresentazione dell'atomo ha cambiato solo alla fine del XIX secolo. Dopo indagini J. Thomson, E. Rutherford, H. Lorenz, P. Zeeman piccole particelle indivisibili nuclei atomici ed elettroni sono stati riconosciuti. Nel corso del tempo, si è scoperto protoni, neutroni, e anche più tardi – il neutrino, kaoni, pioni, ecc …
Ora la scienza conosce un enorme numero di particelle elementari, il luogo di cui invariabilmente occupato e gli elettroni.

La scoperta di una nuova particella
Al tempo in cui erano elettroni scoperti nell'atomo, gli scienziati sanno da tempo l'esistenza di elettricità e magnetismo. Ma la vera natura e le proprietà complete di questi fenomeni sono ancora un mistero, che occupa le menti di molti fisici.
All'inizio del XIX secolo era noto che la propagazione di radiazione elettromagnetica, la velocità della luce. Tuttavia, l'inglese Dzhozef Tomson, conducendo esperimenti con raggi catodici, concluso che sono costituiti da tanti piccoli grani cui massa è inferiore nucleare.

In aprile 1897 Thomson ha fatto un discorso in cui ha presentato la comunità scientifica alla nascita di una nuova particella nella composizione degli atomi, che ha chiamato corpuscolo. Più tardi, Ernest Rutherford utilizzando esperimenti stagnola ha confermato le conclusioni del suo maestro, ed i corpuscoli è stato dato un altro nome – "elettroni".
Questa scoperta ha spinto lo sviluppo della scienza non solo fisico ma anche chimico. E 'possibile compiere progressi significativi nello studio dell'elettricità e del magnetismo, proprietà della materia, e ha dato origine alla fisica nucleare.
Che cosa è un elettrone?
Elettroni – è le particelle più leggere con una carica elettrica. La nostra conoscenza di loro rimangono ancora in gran parte contraddittorie e incomplete. Per esempio, in idee moderne vivono per sempre, perché non rompere, a differenza di neutroni e protoni (crollo teorica dell'ultima era supera l'età dell'universo).
Gli elettroni sono stabili e hanno una costante carica negativa e = 1,6 x 10 -19 Cl. Appartengono alla famiglia dei fermioni e leptoni gruppo. Le particelle coinvolte in un'interazione elettromagnetica e gravitazionale debole. Essi sono costituiti da atomi. Particelle che hanno perso il contatto con gli atomi – elettroni liberi.
La massa di elettroni è 9,1 x 10 -31 kg ed è 1836 volte inferiore alla massa di un protone. Hanno mezza integrale e rotazioni e un momento magnetico. Electron indicata con la lettera "e -". Lo stesso, ma con un segno più indica il suo antagonista – positroni antiparticella.
Stato degli elettroni in un atomo
Quando è diventato chiaro che un atomo è costituito da strutture più piccole, era necessario capire esattamente come sono disposti in esso. Così, alla fine del XIX secolo, è apparso il primo modello dell'atomo. Secondo il modello planetario, protoni (carica positiva) e neutroni (neutro) costituivano il nucleo. A elettroni muoversi in orbite ellittiche.
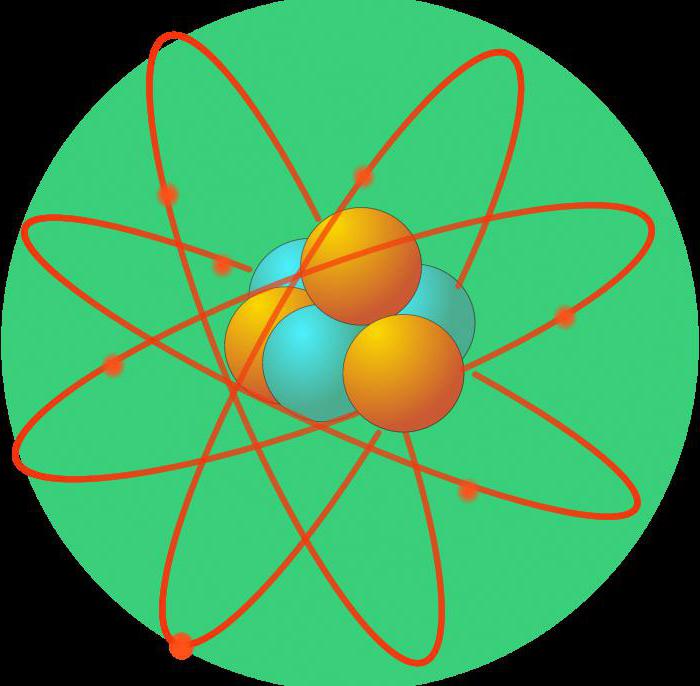
Queste percezioni stanno cambiando con l'avvento della fisica quantistica nei primi anni del XX secolo. Lui De Broglie ha proposto la teoria che l'elettrone si comporta non solo come una particella, ma anche come un'onda. Erwin Schrodinger crea un modello ondulatorio dell'atomo, in cui gli elettroni sono rappresentati da una nuvola con certa densità di carica.

Per individuare la posizione e la traiettoria degli elettroni intorno al nucleo è praticamente impossibile. A questo proposito, introdotto un particolare periodo "orbitale" o "nuvola elettronica", che è lo spazio delle posizioni più probabili di dette particelle.
i livelli di energia
La nube di elettroni attorno ad un atomo altrettanto e protoni nel suo nucleo. Tutti loro sono a distanze diverse. Vicina al nucleo sono elettroni con la minor quantità di energia disposti. L'energia è più nelle particelle, tanto più essi siano.
Ma non sono disposte in modo casuale, e prendono livelli specifici, che possono ospitare solo un certo numero di particelle. Ogni livello ha la propria quantità di energia ed è suddivisa in sotto-livelli, e quelli, a sua volta, sulle orbitali.
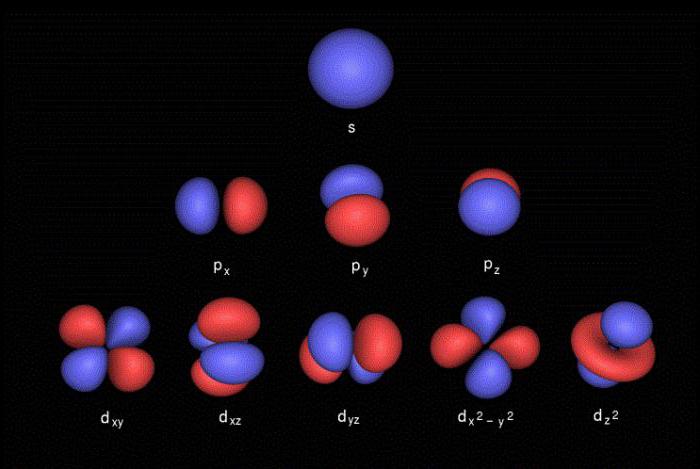
Per descrivere le caratteristiche e la posizione degli elettroni ai livelli energetici, quattro numeri quantici :
- n – la riserva di energia degli elettroni specificando intero principale (corrisponde al numero del periodo elemento chimico);
- l – Codice orbitale, che descrive la forma della nube di elettroni (s – sferica, p – forma otto, d – la forma di trifoglio o doppie otto, f – forma geometrica complessa);
- m – N. magnetica definente orientamento nube in un campo magnetico;
- ms – il numero di spin, che caratterizza l'elettroni orbita attorno al suo asse.
conclusione
Pertanto, gli elettroni – una stalla, particelle caricate negativamente. Essi sono essenziali e non possono decadere in altri elementi. Essi sono indicati come particelle fondamentali, cioè, quelli che fanno parte della struttura della materia.
Gli elettroni si muovono attorno ai nuclei e formano il loro guscio elettronico. Essi influenzano i chimici, proprietà ottiche, meccaniche e magnetiche di varie sostanze. Queste particelle sono coinvolti nell'interazione elettromagnetica e gravitazionale. Il loro movimento direzionale crea un campo magnetico corrente e elettrica.









