Qual è configurazione elettronica potassio
Come funziona la configurazione elettronica di potassio? Per rispondere a questa domanda, considerare la struttura dell'atomo e le regole di distribuzione degli elettroni sui livelli e sottolivelli.
meccanica quantistica
Configurazione potassio elettronico descritto Schrödinger. Si collega l'energia potenziale interazione del nucleo e gli elettroni e la grandezza di repulsione tra particelle aventi la stessa carica. La meccanica quantistica utilizza questa equazione postula che spiega la presenza di ogni del livello di energia da una riserva di energia.
atomi a molti elettroni
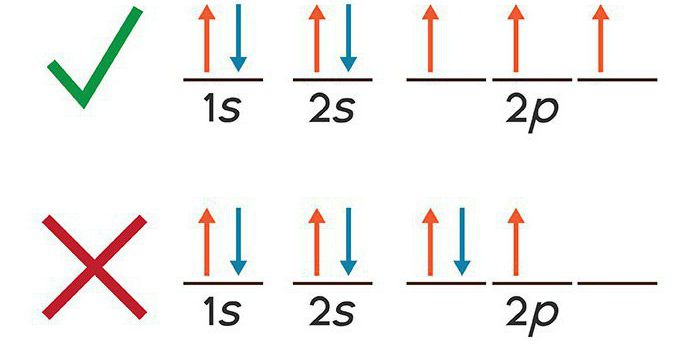
Configurazione potassio elettronico è scritto con il principio di esclusione. Date le caratteristiche della natura ondulatoria degli elettroni, si presume che ogni particella negativa si trova sulla "orbitale", cioè ha una certa esistenza spaziale. Per quanto riguarda atomi multi-elettroni, che comprendono potassio, su ciascun orbitale non può essere situato più di due elettroni. Come risultato è stato allocato quattro numeri quantici che caratterizzano lo stato dell'elettrone nell'intervallo di tempo considerato.
principio Aufbau
Configurazione potassio elettronico è effettuata sulla base delle regole derivate Klechkovskaya. Consideriamo in modo più dettagliato. A seconda di cosa gli elettroni orbitali sono disposti, hanno una certa riserva di energia. In primo luogo v'è la distribuzione di particelle aventi un piccolo alimentatore.
Come caratteristica primaria di energia degli elettroni per serve il numero quantico principale, corrispondente al numero di periodo.
L'atomo attrazione molti elettroni si verifica non solo agli elettroni di base, ma anche una repulsione tra loro. Aumentando le particelle di spin totale diminuisce l'energia del guscio elettronico, aumenta il numero di elettroni aventi lo stesso orientamento del proprio movimento momenti. Tale dipendenza chimica quantistica è chiamata regola di Hund.
Sulla base di queste due regole elaborate configurazione elettronica e atomo di potassio. spettri atomici consentono di determinare lo stato fondamentale degli elettroni, cioè, per identificare quelle particelle che hanno riserve energetiche minime.
L'essenza di costruire formula elettronico per un atomo multi-elettroni di potassio è molto semplice: un sistema elettronico deve avere un'energia minimo corrisponde al principio di esclusione.
Esempi della distribuzione degli elettroni dei livelli energetici
Prima di valutare quanto la configurazione elettronica di ione potassio è un semplice esempio. L'atomo di idrogeno del nucleo comprende un protone positivo. Intorno al nucleo viene ruotato di un elettrone orbita. Lo stato fondamentale della formula idrogeno è la seguente: 1s. Considerate le caratteristiche del l'orientamento della rotazione di questo elettrone. Secondo la regola di Hund, è codirezionale con lo spin nucleare.
Per elio avente un secondo numero di sequenza negli elementi tavola su un orbitali audio due elettroni. Ciascuno di essi ha un mezzo giro, ha una direzione di rotazione diverso.
Negli elementi del secondo livello di energia appare due gusci, ognuno ha la sua energia immagazzinata.
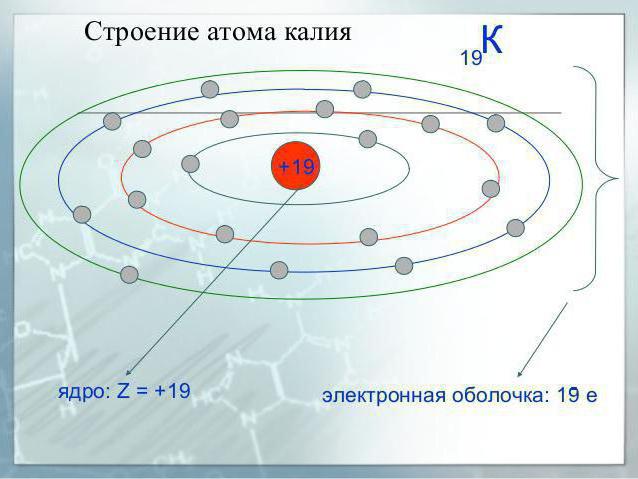
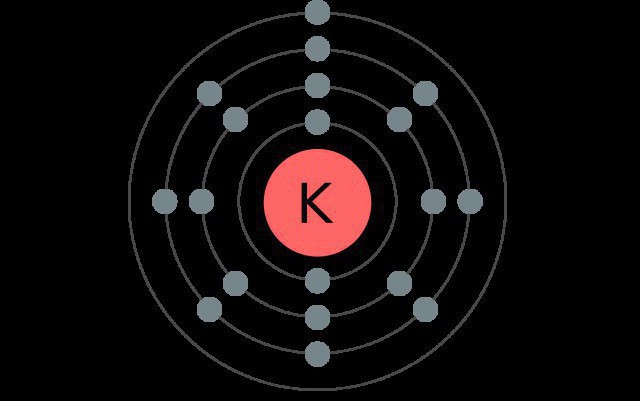
Potassio è l'elemento del quarto periodo, gli elementi del sistema, quindi ha quattro livelli elettronici, ciascuno dei quali contiene diversi tipi di sottolivelli.
Nello stato normale dell'atomo di metallo alcalino ha la seguente configurazione: 1s22s22p63s23p64s1.
configurazione elettronica ione potassio è diverso dall'atomo. A livello di energia esterna del metallo è un elettrone di valenza. Poiché presenta potassio proprietà di riduzione, mentre le interazioni con altri atomi, manda un elettrone di valenza viene convertito in un ione positivo (catione) avente la seguente configurazione elettronica: 1s22s22p63s23p64s0.
conclusione
Per ciascun elemento chimico, si trova nella tavola periodica può creare configurazioni elettroniche, regola armata di Hund, il principio di esclusione, e sinistri Klechkovskii. Oltre alle configurazioni elettroniche degli atomi nella chimica inorganica e costituiscono cationi e anioni formula derivanti da interazioni chimiche.