Proteina: struttura e funzione. Proprietà delle proteine
Come sapete, le proteine sono la base per la nascita della vita sul nostro pianeta. Secondo la teoria di Oparin-Haldane, è la goccia coacervata costituita da molecole peptide che sono diventate la base per la nascita del vivente. Questo è indiscutibile, perché l'analisi della composizione interna di ogni rappresentante della biomassa mostra che queste sostanze esistono in tutto: piante, animali, microrganismi, funghi, virus. E sono molto diverse e macromolecolari in natura.
I nomi di queste strutture sono quattro, sono tutti sinonimi:
- proteine;
- proteine;
- polipeptidi;
- peptidi.

Molecole di proteine
Il loro numero è veramente innumerevole. Inoltre, tutte le molecole proteiche possono essere suddivise in due grandi gruppi:
- Semplice – consistono solo di sequenze aminoacidiche legate da legami peptidici;
- Complesso – la struttura e la struttura della proteina sono caratterizzati da ulteriori gruppi protitici (protesici), chiamati cofattori.
In questo caso, le molecole complesse hanno anche la propria classificazione.
Gradazione di peptidi complessi
- Le proteine glicoproteine sono strettamente correlate con proteine e composti di carboidrati. La struttura della molecola è intrecciata con gruppi protesici di mucopolisaccaridi.
- Lipoproteine – un composto complesso di proteine e lipidi.
- Metalloproteine – come gruppo protesico sono ioni metallici (ferro, manganese, rame e altri).
- Nucleoproteine – il rapporto di proteine e acidi nucleici (DNA, RNA).
- Fosfoproteine – la conformazione della proteina e il residuo dell'acido ortofosforico.
- Le cromoproteine sono molto simili a metalloproteine, ma l'elemento che fa parte del gruppo protesico è un intero complesso colorato (rosso-emoglobina, verde-clorofilla, ecc.).
In ogni gruppo esaminato, la struttura e le proprietà delle proteine sono diverse. Le funzioni che svolgono variano anche a seconda del tipo di molecola.

Struttura chimica delle proteine
Da questo punto di vista, le proteine sono una catena lunga e massiccia di residui di aminoacidi legati tra loro da legami specifici chiamati peptidi. Dalle strutture laterali degli acidi si estendono i radicali. Questa struttura della molecola è stata scoperta da E. Fisher all'inizio del XXI secolo.
Più avanti sono state studiate le proteine, la struttura e le funzioni delle proteine. Divenne chiaro che gli amminoacidi che costituiscono la struttura peptidica sono solo 20, ma possono essere combinati in diversi modi. Da qui la diversità delle strutture polipeptide. Inoltre, nel processo di vita e di svolgimento delle loro funzioni, le proteine sono in grado di subire una serie di trasformazioni chimiche. Di conseguenza, modificano la struttura e viene visualizzato un tipo completamente nuovo di connessione.
Per rompere il legame peptidico, vale a dire rompere la proteina, la struttura delle catene, è necessario selezionare condizioni molto rigorose (l'azione di alte temperature, acidi o alcali, un catalizzatore). Ciò è dovuto all'elevata resistenza dei legami covalenti nella molecola, vale a dire nel gruppo peptidico.

La rilevazione della struttura proteica in condizioni di laboratorio viene effettuata con l'aiuto della reazione biuretica – esposizione al polipeptide con idrossido di rame appena precipitato (II). Il complesso del gruppo peptidico e lo strato di rame danno un colore viola brillante.
Ci sono quattro organizzazioni strutturali principali, ognuna delle quali ha le sue peculiarità nella struttura delle proteine.
Livelli di organizzazione: struttura primaria
Come detto sopra, il peptide è una sequenza di residui di aminoacidi con inclusioni, coenzimi o senza di essi. Quindi la struttura primaria è chiamata struttura molecolare, naturale, naturale, è veramente aminoacidi legati da legami peptidici e nient'altro. Cioè, il polipeptide è lineare. In questo caso, le peculiarità della struttura delle proteine di un tale piano sono che una tale combinazione di acidi è il fattore determinante per la funzione della molecola proteica. A causa della presenza di queste caratteristiche è possibile non solo identificare il peptide, ma anche prevedere le proprietà e il ruolo di un nuovo, non ancora aperto. Esempi di peptidi che possiedono una struttura primaria naturale sono l'insulina, la pepsina, la chimotripsina e altri.
Conformità secondaria
La struttura e le proprietà delle proteine in questa categoria variano leggermente. Tale struttura può essere formata inizialmente dalla natura, sia quando è esposta a idrolisi duro primaria, temperatura o altre condizioni.
Questa conformazione ha tre varianti:
- Girate lisce, regolari e stereoregolari, costruite da residui di amminoacidi, che si snodano attorno all'asse principale dell'articolazione. Sono mantenuti insieme solo da legami di idrogeno tra l'ossigeno di un gruppo peptidico e l'altro idrogeno. E la struttura è considerata corretta perché i giri vengono ripetuti in modo uniforme ogni 4 link. Tale struttura può essere a mano sinistra oa ferita a destra. Ma nelle proteine più conosciute, l'isomero destrorotatorio predomina. Tale conformazione è solitamente chiamata struttura alfa.
- La composizione e la struttura delle proteine del tipo successivo differisce da quella precedente in quanto i legami di idrogeno non si formano tra un certo numero di residui su un lato della molecola ma tra distanze considerevolmente distanti e una distanza sufficientemente larga. Per questa ragione, l'intera struttura assume la forma di diverse catene ondulate, serpentine-polipeptide. C'è una caratteristica che una proteina dovrebbe esibire. La struttura degli amminoacidi sui rami dovrebbe essere il più breve possibile, come ad esempio in glicina o alanina. Questo tipo di conformazione secondaria è chiamato fogli beta per la capacità di stare insieme quando formano una struttura comune.
- La struttura della proteina appartenente al terzo tipo denota come frammenti complessi, dispersi e disordinati che non possiedono stereoregularità e sono in grado di modificare la struttura sotto l'influenza delle condizioni esterne.
Esempi di proteine che hanno una struttura secondaria dalla natura non sono stati identificati.

Istruzione terziaria
Questa è una conformazione piuttosto complessa, chiamata "globula". Qual è una tale proteina? La sua struttura si basa sulla struttura secondaria, ma vengono aggiunti nuovi tipi di interazioni tra gli atomi di raggruppamento e l'intera molecola sembra piegata, orientandosi quindi a far sì che i gruppi idrofili siano diretti nel globule e che i gruppi idrofobici siano diretti verso l'esterno.
Ciò spiega la carica della molecola proteica in soluzioni di acqua colloidale. Quali tipi di interazioni sono presenti?
- I legami idrogeno rimangono invariati tra le stesse parti della struttura secondaria.
- Interazioni idrofobiche (idrofili) – sorgono quando il polipeptide viene sciolto in acqua.
- Attrazione ionica – formata tra i gruppi differenziati di residui di amminoacidi (radicali).
- Le interazioni covalenti – possono formarsi tra siti specifici di acido – molecole di cisteina, o meglio le code.
Pertanto, la composizione e la struttura delle proteine che possiedono una struttura terziaria possono essere descritte come catene di polipeptidi piegate in globuli che mantengono e stabilizzano la loro conformazione attraverso diversi tipi di interazioni chimiche. Esempi di tali peptidi sono: il fosfoglicerato kenasi, il tRNA, la cheratina alfa, la fibra di seta e altri.
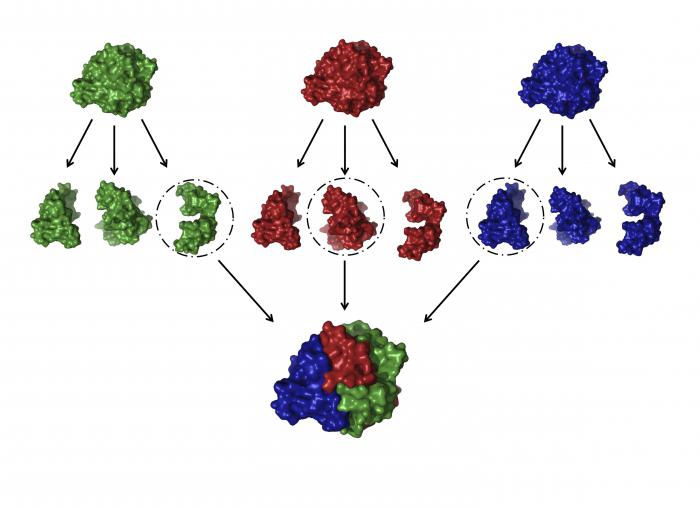
Struttura quaternaria
Questo è uno dei globuli più complessi che formano le proteine. La struttura e le funzioni delle proteine di questo tipo sono molto diverse e specifiche.
Qual è una tale conformazione? Ci sono alcuni (in alcuni casi decine) di grandi e piccole catene di polipeptidi che si formano indipendentemente l'una dall'altra. Ma poi, a causa delle stesse interazioni che abbiamo considerato per la struttura terziaria, tutti questi peptidi sono intrecciati e intrecciati. In questo modo si ottengono globuli conformazionali complessi che possono contenere sia atomi di metallo, gruppi lipidi e gruppi di carboidrati. Esempi di tali proteine sono: DNA polimerasi, proteine della busta di tabacco, emoglobina e altri.

Tutte le strutture peptide esaminate da noi hanno i loro metodi di identificazione in laboratorio, basati sulle moderne possibilità di utilizzare cromatografia, centrifugazione, microscopia elettronica e ottica e tecnologie informatiche elevate.
Funzioni eseguite
La struttura e le funzioni delle proteine sono strettamente correlate tra loro. Cioè, ogni peptide svolge un ruolo determinato, unico e specifico. Ci sono anche coloro che sono in grado di eseguire diverse operazioni significative in una cellula vivente. Tuttavia, è possibile esprimere in forma generalizzata le funzioni di base delle molecole proteiche negli organismi degli esseri viventi:
- Fornire traffico. Gli organismi unicellulari, o gli organelli, o alcuni tipi di cellule sono in grado di movimento, contrazione, movimento. Questo è fornito da proteine che fanno parte della struttura del loro apparato motore: cilia, flagella, membrana citoplasmatica. Se si parla di incapacità di spostare le cellule, le proteine possono contribuire alla loro riduzione (miozina muscolare).
- Funzione nutrizionale o di riserva. Si tratta di un accumulo di molecole proteiche in uova, embrioni e semi vegetali per ricostituire ulteriormente i nutrienti mancanti. Quando si sgretola, i peptidi danno aminoacidi e sostanze biologicamente attive necessarie allo sviluppo normale di organismi viventi.
- Funzione energetica. Oltre ai carboidrati, le proteine possono anche dare forza al corpo. Quando 1 g del peptide viene disintegrato, 17,6 kJ di energia utile viene rilasciata sotto forma di adenosina trifosfato (ATP), che viene consumata su processi vitali.
- Funzione segnale e regolatore. Comprende l'attuazione di un attento monitoraggio dei processi in corso e la trasmissione di segnali da cellule a tessuti, da essi agli organi, dai secondi ai sistemi e così via. Un esempio tipico è l'insulina, che rigida fissa la quantità di glucosio nel sangue.
- Funzione del ricettore. Viene effettuata cambiando la conformazione del peptide da un lato della membrana e coinvolgendo nella ristrutturazione dell'altra estremità. Allo stesso tempo vengono trasmessi il segnale e le informazioni necessarie. Di solito tali proteine sono incorporate nelle membrane citoplasmatiche delle cellule e esercitano un controllo rigoroso su tutte le sostanze che lo attraversano. Notare anche i cambiamenti chimici e fisici nell'ambiente.
- Funzione di trasporto dei peptidi. Viene eseguito da canali proteici e da proteine portanti. Il loro ruolo è ovvio: trasportare le molecole necessarie in luoghi con bassa concentrazione da parti con alto. Un esempio tipico è il trasferimento di ossigeno e anidride carbonica agli organi e ai tessuti dall'emoglobina proteica. Forniscono anche composti con una massa molecolare bassa attraverso la membrana cellulare dentro.
- Funzione strutturale. Uno dei più importanti di quelli che esegue proteine. La struttura di tutte le cellule, i loro organelli è fornita da peptidi. Essi, come uno scheletro, definiscono la forma e la struttura. Inoltre, lo sostengono e modificano se necessario. Pertanto, per la crescita e lo sviluppo, tutti gli organismi viventi hanno bisogno di proteine nella dieta. Questi peptidi includono elastina, tubulina, collagene, actina, cheratina e altri.
- Funzione catalitica. Viene eseguita da enzimi. Numerose e diverse, accelerano tutte le reazioni chimiche e biochimiche del corpo. Senza la loro partecipazione, la solita mela nello stomaco potrebbe essere digerita solo per due giorni, con un'elevata probabilità di decadimento allo stesso tempo. Sotto l'azione della catalasi, della perossidasi e di altri enzimi, questo processo avviene in due ore. In generale, grazie a questo ruolo di proteine, si realizzano l'anabolismo e il catabolismo, ossia il metabolismo plastico e energetico.

Ruolo di protezione
Ci sono diversi tipi di minacce, da cui le proteine sono progettate per proteggere il corpo.
In primo luogo, attacco chimico di reagenti traumatici, gas, molecole, sostanze di diverso spettro di azione. I peptidi sono in grado di interagire con loro in interazione chimica, traducendo in una forma inoffensiva o semplicemente neutralizzando.
In secondo luogo, la minaccia fisica dalle ferite – se il fibrinogeno proteico non si trasforma in fibrina nel sito del danno, allora il sangue non si gonfia, il che significa che non si verifica il blocco. Poi, al contrario, è necessario un peptide di plasmin, che può sciogliere il coagulo e ripristinare la permeabilità del vaso.
In terzo luogo, la minaccia all'immunità. La struttura e l'importanza delle proteine che formano la difesa immunitaria sono estremamente importanti. Anticorpi, immunoglobuline, interferoni sono tutti elementi importanti e significativi del sistema linfatico e immunitario umano. Qualsiasi particella estranea, molecola dannosa, parte di cellule morte o tutta la struttura subisce un'indagine immediata dal composto peptidico. È per questo che una persona può proteggersi indipendentemente da infezioni e virus semplici senza farmaci.
Proprietà fisiche
La struttura della proteina cellulare è molto specifica e dipende dalla funzione eseguita. Ma le proprietà fisiche di tutti i peptidi sono simili e si basano sulle seguenti caratteristiche.
- Il peso molecolare è fino a 1.000.000 Daltoni.
- In soluzione acquosa si formano sistemi colloidali. Lì, la struttura acquista una carica in grado di variare a seconda dell'acidità del mezzo.
- Sotto l'influenza di condizioni dure (irradiazione, acido o alcali, temperatura, ecc.), Sono in grado di passare ad altri livelli di conformazioni, cioè denaturare. Questo processo è irreversibile al 90%. Tuttavia, c'è anche un cambiamento inverso – renaturazione.
Queste sono le principali proprietà delle caratteristiche fisiche dei peptidi.