proteine semplici e complessi. La struttura, le funzioni, le proprietà caratteristiche, esempi di proteine complesse
Una delle definizioni della vita è la seguente: "La vita è il modo di esistenza di corpi di proteine". Sul nostro pianeta, senza eccezione organismi contengono tali materiali organici, come le proteine. Questo articolo descrive le proteine semplici e complessi differenze nella struttura molecolare identificati, e discute le loro funzioni nella cellula.
Quali sono le proteine
Dal punto di vista della biochimica – polimeri organici ad alto peso molecolare, monomeri che sono 20 diversi tipi di aminoacidi. Essi sono uniti insieme da legami covalenti chimici, peptide altrimenti noto. Poiché monomeri proteine sono composti anfoteri, che contengono sia un gruppo ammino e un gruppo funzionale carbossilico. legame chimico CO-NH tra di loro si verifica.
Se il polipeptide è costituito da legami residui di aminoacidi, si forma una proteina semplice. Le molecole del polimero, comprendente inoltre ioni metallici, vitamine, nucleotidi, carboidrati – sono proteine complesse. Successivamente, consideriamo la struttura spaziale di polipeptidi.
Livelli di organizzazione di molecole proteiche
Essi sono presentati in quattro diverse configurazioni. La prima struttura – lineare, è il più semplice e ha la forma di una catena polipeptidica durante la sua spirale la formazione di legami idrogeno aggiuntivi. Essi stabilizzano l'elica, che si chiama una struttura secondaria. terziario istituzioni hanno proteine semplici e complessi, la maggior parte delle cellule vegetali e animali. Quest'ultima configurazione – quaternario nasce nell'interazione di diverse molecole della struttura originaria, coenzimi uniti, ovvero tali proteine hanno una struttura complessa, operano in varie funzioni del corpo.
Una varietà di proteine semplici
Questo gruppo non è numerosi polipeptidi. Le loro molecole sono costituiti solo di residui di aminoacidi. Per includere proteine, come istoni e globuline. Il primo rappresentato nella struttura di nucleo, e sono combinati con le molecole di DNA. Il secondo gruppo – globuline – sono i principali componenti del plasma sanguigno. Tale proteina come gamma globulina, svolge le funzioni di difesa immunitario ed è un anticorpo. Questi composti possono formare complessi, che contengono carboidrati complessi e proteine. Tali proteine fibrillari semplici come il collagene e l'elastina, sono parte del tessuto connettivo, cartilagine, tendini, pelle. La loro funzione principale – la costruzione e il sostegno.
proteina tubulina è un membro di microtubuli, che sono componenti di ciglia e flagelli organismi unicellulari come ciliati, Euglena, flagellati parassiti. Questa stessa proteina è un membro di organismi multicellulari (flagelli spermatozoi, ciglia ovuli, epitelio ciliato dell'intestino tenue).
La proteina albumina serve per fare scorta di una funzione (ad esempio, una proteina di uova di gallina). Nel endosperma di semi di cereali – segale, riso, frumento – molecole proteiche si accumulano. Essi sono chiamati inclusioni cellulari. Queste sostanze vengono utilizzate nell'embrione seme agli inizi del suo sviluppo. Inoltre, l'elevato contenuto proteico del punteruolo del grano è un indicatore molto importante della qualità della farina. Pane cotto con farina ricca di glutine ha una alta qualità sapore e più utile. Il glutine di grano contiene cosiddetta difficile. L'altura pesce plasma sanguigno contiene proteine che impediscono la loro morte per il freddo. Possiedono le proprietà antigelo, impedendo la morte dell'organismo a basse temperature dell'acqua. D'altra parte, nella composizione della parete cellulare di batteri termofili a fonti geotermiche contenuta proteine in grado di mantenere la sua configurazione naturale (struttura terziaria o quaternaria) e non denaturare a temperature comprese tra +50 e + 90 ° C.
proteid
Queste sono proteine complesse, che sono caratterizzati da una grande diversità in relazione alle varie funzioni da essi. Come notato in precedenza, il gruppo di polipeptidi, ad eccezione della porzione proteica contiene un gruppo prostetico. Sotto l'influenza di vari fattori quali temperatura elevata, sali di metalli pesanti, concentrato proteine complesse alcalini e acidi possono alterare la forma spaziale, semplificando esso. Questo fenomeno è chiamato denaturazione. La struttura delle proteine complesse è interrotto legami idrogeno sono rotti, e le molecole perdono le loro proprietà e funzioni. Come regola generale, la denaturazione è irreversibile. Ma alcuni dei polipeptidi agiscono come catalizzatore, conduzione e funzioni di segnalazione, è possibile rinaturazione – ripristinando la struttura naturale delle proteidi.

Se l'azione è un fattore destabilizzante andare per un lungo periodo di tempo, la molecola proteica è distrutta completamente. Questo porta alla rottura dei legami peptidici della struttura primaria. Ripristino della proteina e la sua funzione non è più possibile. Questo fenomeno si chiama distruzione. Un esempio è la cottura delle uova: proteine liquide – albumina, situato nella struttura terziaria è completamente distrutta.
biosintesi delle proteine
Ancora una volta, ricordare che nei polipeptidi di organismi viventi è costituito da 20 aminoacidi, alcuni dei quali sono insostituibili. Questo lisina, metionina, fenilalanina, e così via. D. entrano nel flusso sanguigno dal piccolo intestino dopo dividendolo prodotti proteici. Per sintetizzare amminoacidi essenziali (alanina, prolina, serina), funghi e animali usano composti contenenti azoto. Piante, essendo autotrofi, formano indipendentemente un necessarie monomeri costituenti rappresentano proteine complesse. Per questo le reazioni di assimilazione sono i nitrati usati, ammoniaca o esenti da azoto. In alcuni tipi di microorganismi stessi fornire un set completo di amminoacido, mentre in altri solo alcuni sono sintetizzati monomeri. Le fasi della biosintesi delle proteine si verificano nelle cellule di tutti gli organismi viventi. Al centro della trascrizione si verifica, e nel citoplasma della cellula – trasmissione.
Il primo passo – la sintesi dell'mRNA precursore avviene l'enzima polimerasi RNA. Egli rompe i legami idrogeno tra le catene del DNA, e uno di loro sul principio di complementarietà raccoglie pre-mRNA molecola. È esposta ai slaysingu cioè maturi, e quindi esce dal nucleo al citoplasma, formando acido ribonucleico messaggero.
Per implementare la seconda fase richiede una specifica organuli – ribosomi e informazioni molecolari e trasferire acidi ribonucleici. Un'altra condizione importante è la presenza di ATP, come le reazioni metabolismo plastica, che appartiene alla biosintesi delle proteine si verifica con l'assorbimento di energia.
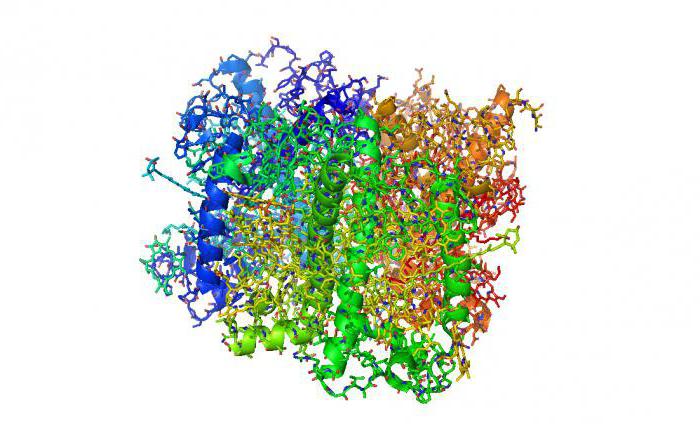
Enzimi, la loro struttura e funzione
Questo è un grande gruppo di proteine (circa 2000), svolgendo il ruolo di sostanze che influenzano la velocità delle reazioni biochimiche nelle cellule. Essi possono essere semplici (trepsin, la pepsina) o complessa. proteine complesse compresi di apoenzyme e coenzima. La specificità della proteina rispetto ai composti che agisce, determina un coenzima, e l'attività protidi si osserva solo nel caso in cui la componente proteica legata alla apoenzyme. L'attività catalitica dell'enzima è indipendente della molecola, ma soltanto dal centro attivo. La sua struttura corrisponde alla struttura chimica delle sostanze catalizzate dal principio di "key-lock", in modo che l'azione degli enzimi è strettamente specifico. Funzioni delle proteine complessi sono in partecipazione nei processi metabolici e nel loro utilizzo come accettori.
Classi di proteine complesse
Essi sono stati sviluppati da biochimici, in base a 3 criteri: proprietà fisico-chimiche, caratteristiche e caratteristiche strutturali protidi specificità. Il primo gruppo comprende i polipeptidi differenti proprietà elettrochimiche. Essi sono suddivisi in base, neutro e acido. Rispetto alle proteine acqua può essere idrofilo, anfifilico e idrofobo. Il secondo gruppo di enzimi che sono state considerate in precedenza. Il terzo gruppo comprende polipeptidi che differiscono in composizione chimica (gruppo prostetico è chromoproteids, nucleoproteine, metalloproteine).
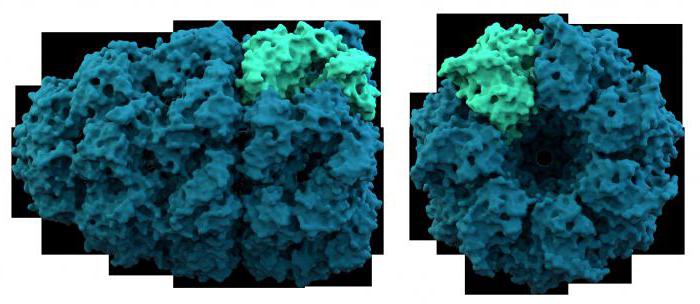
Considerate le proprietà delle proteine complesse in modo più dettagliato. Così, per esempio, proteina acidica che fa parte dei ribosomi, contiene 120 aminoacidi ed è versatile. Si trova nei organelli proteina-sintetizzare, sia le cellule procariote ed eucariote. Un altro membro di questo gruppo – proteina S-100, costituito da due catene collegati ione calcio. È membro di neuroni e glia – sostenere il tessuto del sistema nervoso. La proprietà comune di tutte le proteine acide – un alto contenuto di acidi dicarbossilici: glutammico e aspartico. Con proteine alcaline includere istoni – proteine che compongono RNA e DNA acidi nucleici. La particolarità della composizione chimica è la grande quantità di lisina e arginina. Gli istoni, insieme con la forma dei cromosomi cromatina nucleare – critica la struttura delle cellule ereditarietà. Queste proteine sono coinvolte nei processi di trascrizione e traduzione. proteine anfifilici ampiamente rappresentate nelle membrane cellulari, formando un doppio strato lipoproteina. Così, il gruppo ha studiato le proteine complesse sopra discusso, siamo convinti che le loro proprietà fisico-chimiche dovute alla struttura della componente proteica e gruppi prostetici.
Alcune proteine di membrana cellulare complessi sono in grado di riconoscere una varietà di composti chimici come antigeni e reagire ad essi. Questa segnalazione protidi funzione, è molto importante per i processi di assorbimento selettivo, sostanze dall'ambiente esterno, e per proteggerla.
Glicoproteine e proteoglicani
Essi sono proteine complesse che differiscono tra una composizione biochimica gruppi prostetici. Se i legami chimici tra la componente proteica e la parte carboidrato – covalentemente-glicoside, tali sostanze sono chiamate glicoproteine. Apoenzyme hanno presentato molecole di mono- e oligosaccaridi, esempi di tali proteine sono protrombina, fibrinogeno (proteine coinvolte nella coagulazione del sangue). Kortiko- e gonadotropinici ormoni, interferoni, enzimi e membrane sono glicoproteine. Nelle molecole parte proteica proteoglicano è solo il 5%, il resto essendo un gruppo prostetico (geteropolitsaharid). Entrambe le parti sono collegate da un legame glicosidico dei gruppo-treonina e arginina gruppi OH e NH₂-glutamina e lisina. molecole dei proteoglicani svolgono un ruolo molto importante nelle cellule acqua-sale metabolismo. Di seguito una tabella di proteine complesse, abbiamo studiato.
| glicoproteine | proteoglicani |
| Componenti strutturali di gruppi prostetici | |
| 1. monosaccaridi (glucosio, galattosio, mannosio) | 1. Acido Ialuronico |
| 2. oligosaccaridi (maltosio, lattosio, saccarosio) | 2. Acido condroitina. |
| 3. I derivati aminoacidi acetilati di monosaccaridi | 3. eparina |
| 4. Dezoksisaharidy | |
| 5. acidi neuraminico e sialico | |
metalloproteine
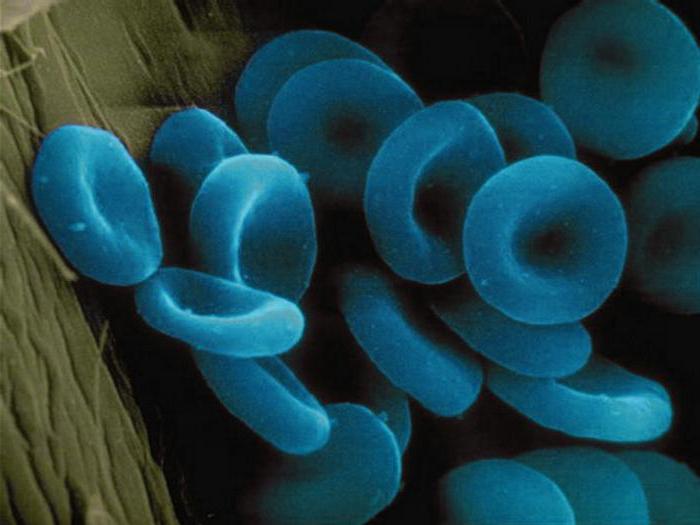
Questi materiali contengono come parte del suo ione molecolare di uno o più metalli. Considerazione esempi di proteine complesse appartenenti al gruppo sopra. Sono soprattutto gli enzimi come la citocromo ossidasi. Si trova sulla creste dei mitocondri e attiva la sintesi di ATP. Ferrin e transferrina – proteid contenente ioni di ferro. li deposita origine nelle cellule, e il secondo è il trasporto di proteine del sangue. Un'altra metalloproteine – alfaamelaza esso contiene ioni calcio è incluso nella composizione della saliva e succo pancreatico, partecipando alla scissione dell'amido. L'emoglobina è il modo metalloproteine e hromoproteidov. Egli serve come una proteina di trasporto che trasporta l'ossigeno. Il risultato è un composto di ossiemoglobina. L'inalazione di ossido di carbonio, oppure monossido di carbonio chiamata, le sue molecole di emoglobina formare eritrociti composti molto stabili. Si diffonde rapidamente per organi e tessuti, causando l'avvelenamento delle cellule. Come risultato, l'inalazione prolungato di morte monossido di carbonio avviene per asfissia. L'emoglobina trasporta parzialmente e anidride carbonica formata nei processi catabolici. Dal sangue di anidride carbonica ai polmoni e ai reni, e da loro – verso l'ambiente esterno. Alcuni crostacei e molluschi proteina di trasporto che trasporta l'ossigeno, è la serratura. Invece del ferro che contiene ioni di rame, in modo da sangue animale non rosso e blu.
funzione clorofilliana
Come abbiamo accennato in precedenza, le proteine complesse possono formare complessi con pigmenti – sostanze organiche colorate. Il loro colore dipende gruppi hromoformnyh che assorbono selettivamente alcuni spettri di luce solare. In cellule vegetali ha plastidi verde – cloroplasti contenenti clorofilla pigmento. È composta da atomi di magnesio e un alcool poliossidrilico, phytol. Essi sono associati con le molecole proteiche, e si contengono cloroplasti tilacoidi (piastre) o membrana associati in pile – sfaccettatura. Sono pigmenti fotosintetici – clorofilla e carotenoidi – aggiuntivi. Ecco tutti gli enzimi utilizzati nelle reazioni fotosintetiche. Così chromoproteids, che comprendono la clorofilla, svolgono funzioni critiche nel metabolismo, vale a dire nelle reazioni assimilazione e dissimilazione.
proteine virali
Essi comprendono i rappresentanti di forme non-cellulari di vita, entrando nel regno di Vir. I virus non hanno un proprio apparato proteina-sintetizzare. Gli acidi nucleici, DNA o RNA, possono indurre la sintesi della maggior parte delle particelle stesse cellule infettate con il virus. Semplici virus costituiti solo da molecole proteiche, compatto assemblati in una struttura elicoidale o una forma poliedrica, come il virus del mosaico del tabacco. virus complessi hanno membrana addizionale formante parte della membrana plasmatica della cellula ospite. Come si può comprendere glicoproteine (virus dell'epatite B, virus del vaiolo). La funzione principale delle glicoproteine – il riconoscimento di specifici recettori sulla membrana della cellula ospite. La composizione delle membrane virali supplementari e proteine includono enzimi che forniscono raddoppiamento di DNA o RNA trascrizione. Sulla base di quanto precede, si può concludere il seguente: proteine virali particelle shell hanno una struttura specifica, a seconda delle proteine di membrana della cellula ospite.
In questo articolo abbiamo date le caratteristiche di proteine complesse, studiata la loro struttura e funzione in cellule di vari organismi.