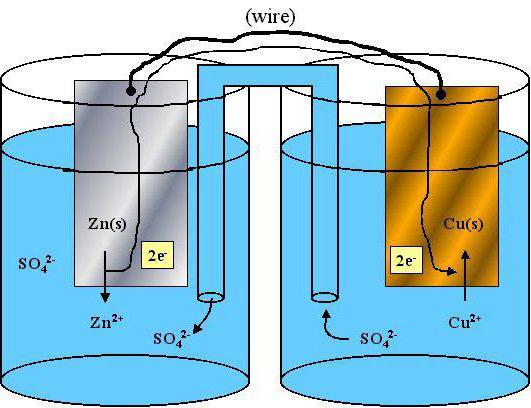
… proprietà riducenti hanno proprietà redox
proprietà redox di singoli atomi e ioni sono un aspetto importante della chimica moderna. Questo materiale aiuta a spiegare la forza degli elementi e sostanze per condurre un confronto dettagliato delle proprietà chimiche dei vari atomi.

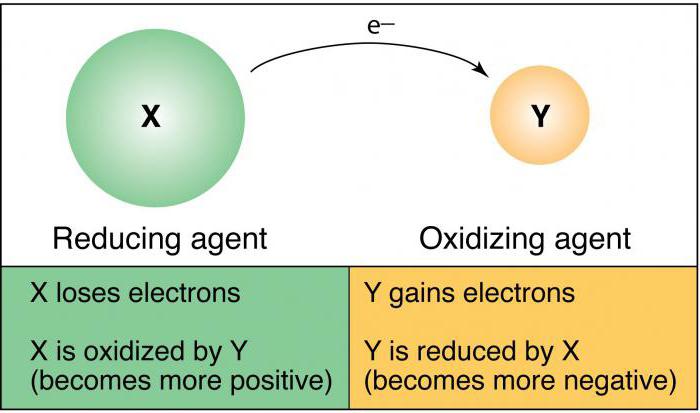
Qual è l'agente ossidante
Molti problemi in chimica, tra cui domande della prova dell'esame di Stato unitario in grado 11, e JEG del 9 ° anno, associati a questo concetto. L'ossidante è considerato atomi o ioni, che nel corso di interazione chimica accettano elettroni da un altro ione o atomo. Se analizziamo le proprietà ossidanti di atomi hanno bisogno di sistema periodico di Mendeleev. Nel periodo, che si trovano nella tabella da sinistra a destra, la capacità ossidante degli atomi aumenta, cioè, avere analoghe proprietà non metallici. Il parametro simile sottogruppi principali diminuisce verso il basso. Tra i più potenti di sostanze semplici che hanno una capacità ossidante, portare il fluoruro. Un termine come "elettronegatività", è possibile adottare un atomo nel caso di interazione chimica degli elettroni può essere considerato sinonimo di proprietà ossidanti. Tra sostanze complesse che comprendono due o più elementi chimici possono essere considerati ossidanti luminose: permanganato di potassio, potassio clorato, ozono.

Qual è il riducente
Riducendo le proprietà tipiche per gli atomi di sostanze semplici che presentano proprietà metalliche. Nei periodi di tavola periodica nelle proprietà metalliche, indeboliscono, e in sottogruppi principali (verticale), essi vengono amplificati. L'essenza del recupero nell'impatto degli elettroni, che si trovano sul livello di energia esterna. Maggiore è il numero di gusci di elettroni (livelli), il più facile da trasmettere durante l'interazione chimica degli elettroni "extra".
Eccellenti proprietà riducenti hanno metalli (alcalini, alcalino-terrosi) attivi. Inoltre, le sostanze esibendo parametri simili che contraddistinguono l'ossido di zolfo (6), il monossido di carbonio. Al fine di ottenere il massimo grado di ossidazione, i composti devono mostrare riducenti.
Il processo di ossidazione
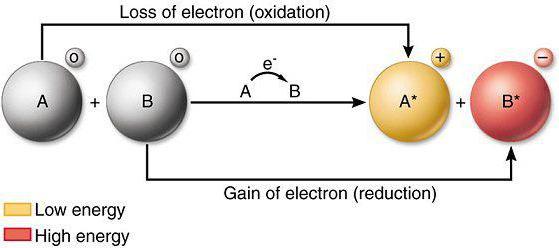
Se, durante l'interazione chimica dell'atomo o ione perde elettroni ad un altro atomo (ione), si riferisce al processo di ossidazione. Per un'analisi di come alterazioni che riducano le proprietà e capacità ossidativa, elementi della tavola periodica, così come la conoscenza delle attuali leggi della fisica richiesti.

processo di recupero
processi di riduzione prevedono l'adozione di ioni o elettroni da atomi di altri atomi (ioni) durante l'interazione chimica diretta. agenti riducenti Eccellenti sono i nitriti, solfiti di metalli alcalini. Riducendo proprietà degli elementi del sistema di cambio proprietà del metallo simili a sostanze semplici.
Algoritmo di analisi OVR
Per reazione chimica pronta dello studente di organizzare i coefficienti, è necessario utilizzare uno speciale algoritmo. proprietà redox aiutare a risolvere una serie di attività di progettazione in analitica, organica, chimica generale. Ordinare offre alcuna analisi della reazione:
- In primo luogo, è importante definire ciascun elemento stato disponibile ossidazione, utilizzando le regole.
- Prossimo definire tali atomi o ioni che hanno cambiato il loro stato di ossidazione per essere coinvolti nella reazione.
- Marks "meno" e "più" indicano il numero del cast adottata durante la reazione chimica degli elettroni liberi.
- Inoltre, tra il numero di elettroni è determinato dal minimo comune multiplo, ossia un numero intero che è divisibile per elettroni accettati e restituite.
- Poi si è diviso in elettroni che partecipano a reazioni chimiche.
- Successivamente, determiniamo esattamente quali ioni o atomi avere proprietà riducenti, nonché determinare ossidanti.
- Nella fase finale di coefficienti di posa in Eq.
Applicando il metodo della bilancia elettronica, per posizionare i coefficienti in un dato schema di reazione:
NaMnO 4 + acido solforico + idrogeno solforato = S + Mn SO 4 + … + …
Algoritmo per risolvere questo problema
Scopriamo esattamente quello che dovrebbe essere formata dopo l'interazione della materia. Poiché la reazione è già ossidante (saranno manganese) e definita agente riducente (sarà zolfo) sostanza formata che non sta cambiando il grado di ossidazione. Poiché la reazione principale si svolge tra il sale e l'acido forte contenente ossigeno, quindi una delle sostanza fine sarà acqua, e la seconda – sale sodico, più precisamente, solfato di sodio.
Torniamo ora schema e l'adozione dell'elettrone:
– Mn +7 prende 5 e = Mn +2.
La seconda parte del sistema:
– S -2 = S 0 otdaet2e
Mettiamo nei tassi di reazione iniziale, senza dimenticare riassumere tutti gli atomi di zolfo nei lati dell'equazione.
2NaMnO 4 + 5H 2 S + 3H 2 SO 4 = 5S + 2MnSO 4 + 8H 2 O + Na 2 SO 4.
Parsing OVR coinvolgendo perossido di idrogeno
Applicando l'analisi OVR algoritmo può equiparare la reazione chimica:
perossido di idrogeno + acido solforico + potassio permagnanat = Mn SO 4 + ossigeno + … + …
Ossidazione cambiato ioni ossigeno (perossido di idrogeno) e cationi manganese permanganato di potassio. Cioè, un agente riducente ed un agente ossidante, che sono presenti.
Definire ciò che un materiale può ancora accadere dopo l'interazione. Uno di questi è l'acqua, che ovviamente è rappresentato dalla reazione tra l'acido e il sale. Potassio non formare una nuova sostanza, il secondo prodotto sale di potassio, solfato cioè, come la reazione procedeva con acido solforico.
driving:
2O – 2 dà elettroni e trasformato in O 2 0 5
Mn +7 5 riceve elettroni e diventa uno ione Mn 2 +2
Abbiamo messo i tassi.
5H 2 O 2 + 3H 2 SO 4 + 2KMnO = 5O 2 4 + 2Mn SO 4 + 8H 2 O + K 2 SO 4
ESEMPIO parsing OVR con potassio cromato
Utilizzando il metodo di bilancia elettronica, stabilire un'equazione a coefficienti:
FeCl 2 + Acido cloridrico + potassio cromato = FeCl 3 + CrCl 3 + … + …
Modificato ossidazione del ferro stato (cloruro di ferro in II) e cromo ione in bicromato di potassio.
Ora cerchiamo di capire che cosa si formano altre sostanze. Si può essere un sale. Potassio non si forma alcun composto così il secondo prodotto è un sale di potassio, più precisamente, cloruro, poiché la reazione è avvenuta con acido cloridrico.
Al diagramma:
Fe +2 invia e = Fe +3 6 riducente
2cr +6 6 riceve e = 2cr +3 1 ossidante.
Noi poniamo i coefficienti nella reazione iniziale:
6K 2 Cr 2 O 7 + FeCl 2 + 14HCl = 7H 2 O + 6FeCl 3 + 3 + 2CrCl 2KCl
ESEMPIO parsing OVR con ioduro di potassio
Armati con le regole, stabilire un'equazione:
permanganato di potassio + acido solforico + potassio ioduro, solfato di manganese + … iodo + … + …
stato di ossidazione cambiato manganese e iodio. Questo è il riducente e ossidante sono presenti.
Ora scopriamo alla fine abbiamo formato. Il composto avrà potassio, cioè ottenere solfato di potassio.
processi di riduzione si verificano nelle ioni iodio.
Formare lo schema di trasferimento di elettroni:
– Mn +7 5 riceve e = Mn +2 2 è un agente ossidante,
– 2I – dà E = I 2 2 0 5 è un agente riducente.
Organizziamo i coefficienti nella reazione iniziale, mentre non dimenticare di riassumere tutti gli atomi di zolfo nell'equazione.
210KI + KMnO 4 + 8H 2 SO 4 = 2MnSO 4 + 2 + 5I 6K 2 SO 4 + 8H 2 O
ESEMPIO parsing OVR con solfito di sodio
Utilizzando il metodo classico, traiamo le combinazioni per l'equazione:
– Acido solforico + KMnO 4 + … solfito di sodio, solfato di sodio, solfato di manganese + … + … +
Dopo reazione ottenere acqua sale sodico.
Al diagramma:
– Mn +7 5 riceve e = Mn +2 2
– S 4 2 invia e = S +6 5.
Organizziamo i coefficienti di questa reazione non è dimenticare di mettere gli atomi di zolfo nella creazione di coefficienti.
3H 2 SO 4 + 4 + 2KMnO 5nA 2 SO 3 = K 2 SO 4 + 4 + 2MnSO 5nA 2 SO 4 + 3H 2 O.
ESEMPIO parsing OVR con azoto
Completare le seguenti attività. Usando l'algoritmo, formiamo un'equazione di reazione completo:
– nitrato di manganese + acido nitrico + PbO 2 = HMnO 4 + Pb (NO 3) 2 +
Analizziamo quale sostanza anche le forme. Poiché la reazione è stata mantenuta tra un forte agente ossidante e sale, allora la sostanza è acqua.
Mostreremo la variazione del numero di elettroni:
– Mn +2 5 invia e = Mn +7 2 presenta le proprietà di un agente riducente,
– Pb 4 2 riceve e = Pb 2 5 ossidante.
3. Organizziamo i coefficienti nella reazione iniziale, accuratamente aggiungono tutto l'azoto presente nel lato sinistro dell'equazione iniziale:
– 2Mn (NO 3) 2 + 3 + 6HNO 5PbO 2 = 2HMnO 4 + 5PB (NO 3) 2 + 2H 2 O.
In questa reazione, proprietà riducenti non si manifestano azoto.
Un secondo campione della reazione redox con azoto:
Zn + acido solforico + HNO 3 = ZnSO4 + NO + …
– Zn 0 2 invia e = Zn +2 3 essere riducente,
N +5 3 riceve e = N + 2 2 è l'ossidante.
Poniamo i coefficienti in una reazione predeterminata:
3Zn + 3H 2 SO 4 + 3 = 2HNO 3ZnSO 4 + 2NO + 4H 2 O.
Il significato delle reazioni redox
La reazione più noto riduzione – la fotosintesi, una pianta tipica. Come modificare le proprietà di recupero? Il processo avviene nella biosfera, porta ad un aumento di energia con una sorgente esterna. E 'questa energia e utilizza per le loro esigenze di umanità. Esempi di ossidanti e ridurre le reazioni associate agli elementi chimici, sono di particolare importanza convertire composti di azoto, carbonio, ossigeno. Attraverso la fotosintesi l'atmosfera terrestre ha una tale composizione che è necessario per lo sviluppo di organismi viventi. Attraverso la fotosintesi non aumenta anidride carbonica nella cassa d'aria, la superficie della Terra non è surriscaldato. La pianta sviluppa non solo attraverso reazione redox, ma le forme tali sostanze per gli esseri umani, come ossigeno, glucosio desiderato. Senza questa reazione chimica non può essere un ciclo completo della materia nella natura, così come l'esistenza della vita organica.
Applicazione pratica OVR
Al fine di mantenere la superficie del metallo, è necessario sapere che hanno proprietà di riduzione metalli attivi, quindi è possibile coprire lo strato superficiale sull'elemento attivo, rallentando così il processo di corrosione chimica. A causa delle proprietà redox per la pulizia e la disinfezione dell'acqua potabile. Nessuno problema non può essere risolto senza aver posizionato correttamente nei coefficienti dell'equazione. Per evitare errori, è importante avere un'idea di tutti i parametri redox.
Protezione contro la corrosione chimica
Sfida particolare per la vita e l'attività umana è la corrosione. Come risultato della conversione chimica di fallimento metallo, perdendo le loro parti di automobili di prestazioni, macchine utensili. Per correggere tale problema, utilizzando protezione sacrificale, uno strato di rivestimento metallico di vernice o dipingere applicazione leghe anticorrosivi. Per esempio, superficie in acciaio è ricoperta da uno strato di metallo attivo – alluminio.
conclusione
Una varietà di reazioni di riduzione avviene nel corpo, garantire il normale funzionamento del sistema digestivo. Tali processi vitali di base la fermentazione, la putrefazione, la respirazione, anche associati con riducenti. Hanno caratteristiche simili, tutte le creature viventi sul nostro pianeta. Senza reazione con impegno e l'accettazione di elettroni non può essere mineraria, la produzione industriale di ammoniaca, alcali, acidi. In tutte le tecniche di chimica analitica analisi volumetrica si basa sui processi redox. Combattere con tale spiacevole fenomeno di corrosione chimica, è anche basata sulla conoscenza di questi processi.