Composti di zolfo. Grado di ossidazione dello zolfo nei composti. Composti di zolfo di formula
calcogeno sottogruppo comprende zolfo, – un secondo elemento che è in grado di formare un gran numero di depositi di minerale. Solfati, solfuri, ossidi di altri composti dello zolfo sono molto diffuse e importanti natura industriale. Pertanto, in questo articolo andremo a guardare a ciò che sono, che rappresenta uno zolfo per sé, è una questione semplice.

Zolfo e la sua caratterizzazione
Questo elemento ha la seguente posizione nel sistema periodico.
- Il sesto gruppo, il gruppo principale.
- Un terzo piccolo periodo.
- massa atomica – 32,064.
- Numero di serie – 16, protoni ed elettroni e 16 neutroni.
- Si riferisce agli elementi, non metalli.
- Nelle formule letto come "es", il nome dello zolfo elemento, zolfo Latina.
In natura, ci sono quattro isotopi stabili con numeri di massa 32,33,34 e 36. Questo elemento del sesto più comune in natura. Si riferisce agli elementi biogeni, come parte di importanti molecole organiche.
La struttura elettronica dell'atomo
composti dello zolfo sono causa di una serie di caratteristiche della struttura elettronica dell'atomo. Essa è espressa dalla seguente formula configurazione: 1s 2s 2 2p 2 2 6 3s 3p 4.
L'ordine sopra riflette uno stato stazionario dell'elemento. Ma sappiamo che se l'atomo di fornire potenza aggiuntiva, è possibile accoppiare rottura elettroni a 3p e 3s-substrato, seguita da un'altra transizione al 3D, che rimane libero. Come risultato, non solo cambia la valenza dell'atomo, ma anche tutti i possibili stati di ossidazione. Il loro numero è notevolmente aumentato, così come il numero di sostanze diverse con lo zolfo.
Grado di ossidazione dello zolfo nei composti
Ci sono diverse opzioni di base di questo indicatore. Lo zolfo è:
- -2;
- +2;
- 4;
- 6.
Di questi, il più raro S 2, il resto sono sparsi in tutto il mondo. Il grado di ossidazione di composti di zolfo nella reattività dipendente e potere ossidante di tutte le sostanze. Ad esempio, i composti con -2 – è solfuri. Ci hanno considerato un elemento tipico del agente ossidante.
Più alto è il grado di ossidazione nel composto, più pronunciato avranno capacità ossidante. Questo è facilmente visibile se ricordiamo i due acidi di base che formano lo zolfo:
- H 2 SO 3 – solforoso;
- H 2 SO 4 – acido solforico.
E 'noto che quest'ultimo è molto più stabile, forte composto avente una elevata concentrazione di molto grave capacità di ossidare.
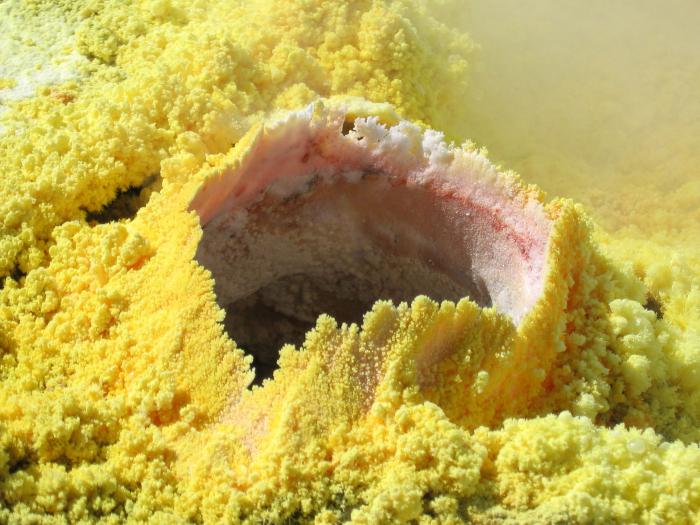
sostanza semplice
Come semplice zolfo sostanza è un giallo cristalli belle piatta allungata corretta. Anche se questa è solo una delle sue forme, perché ci sono due principali forme allotropiche di questa sostanza. In primo luogo, monoclino o orthorhombic – questo è un giallo sostanza cristallina, non solubile in acqua, ma solo in solventi organici. fragilità caratterizzato e bella struttura forma rappresentata nella forma di una corona. Punto di fusione – circa 110 0 C.
Se non saltare il punto intermedio riscaldando una tale modifica, è possibile rilevare tempestivamente un altro stato – plastica zolfo. È una soluzione marrone viscosa gommosa, che in seguito ulteriore riscaldamento o raffreddamento rapido nuovamente passa nella forma romboidale.
Se parliamo di zolfo chimicamente puro, ottenuto da più filtrazioni, è un luminoso cristalli gialli piccoli, fragili e completamente insolubili in acqua. incendio capace a contatto con l'umidità e l'ossigeno atmosferico. Differire sufficientemente elevata attività chimica.

Essere in natura
In natura, ci sono deposito naturale da cui composti di zolfo si sono estratti come sostanza semplice. Inoltre, contiene:
- in minerali, minerali e rocce;
- in animali, piante ed esseri umani, come una parte di molte molecole organiche;
- nei gas naturale, petrolio e carbone;
- in scisti bituminosi e acque naturali.
È possibile citarne alcuni dei più ricchi minerali di zolfo:
- cinabro;
- pirite;
- sfalerite;
- stibnite;
- Galena e altri.
La maggior parte dello zolfo prodotto oggi va per la produzione di solfato. Un'altra parte è utilizzata per scopi medici, agricoltura, prodotti chimici industriali processi di produzione.
proprietà fisiche
Essi possono descrivere in pochi paragrafi.
- L'acqua è insolubile in solfuro di carbonio, trementina, o – sciogliere completamente.
- attrito prolungata accumula carica negativa.
- Punto di fusione di 110 0 C.
- Il punto di ebollizione di 190 0 C.
- Dopo aver raggiunto 300 0 C passa liquido scorre.
- Una sostanza pura è in grado di auto-ignite proprietà infiammabili sono molto buone.
- Di per sé ha quasi nessun odore, ma composti solforati idrogeno emettono un odore pungente di uova marce. Nonché alcuni rappresentanti di binario gassoso.
Le proprietà fisiche della sostanza in questione era nota per le persone fin dai tempi antichi. E 'per la loro combustibilità dei zolfo e ha preso il nome. Nelle guerre utilizzati asfissianti e vapori tossici che vengono generati durante la combustione del composto, come un'arma contro i nemici. Inoltre, l'acido di zolfo anche sempre avuto importanza industriale.

proprietà chimiche
Oggetto: "Zolfo e suoi composti" non ci vuole una lezione nel corso di chimica della scuola, ma diversi. Dopo tutto, molti di loro. Ciò è dovuto alla attività chimica della sostanza. Può essere entrambe le proprietà ossidanti con forti agenti riducenti (metalli, boro, ecc), e il ripristino della maggior parte dei non-metalli.
Tuttavia, anche se tale attività solo con l'interazione di fluoro procede in condizioni ordinarie. Per tutti gli altri, si vuole riscaldare. diverse categorie di materiali possono essere designati, che è capace di reagire con zolfo:
- metalli;
- non metalli;
- alcali;
- acido forte ossidante – solforico e nitrico.
Composti di zolfo: specie
Varietà loro valore sarà spiegata con diversi gradi di ossidazione di base – zolfo. Così, alcuni tipi di base di sostanze possono essere identificati in base a:
- composto con ossidazione -2;
- 4;
- 6.
Se consideriamo le classi, e non un indicatore di valenze, questo elemento forme tali molecole quali:
- acido;
- ossidi;
- composti di zolfo, idrogeno
- sale;
- Composti binari con non-metalli (solfuro di carbonio, cloruri);
- sostanze organiche.
Consideriamo ora i principali, e fornire esempi.

Sostanze con ossidazione -2
composti di zolfo 2 – è la sua conformazione con i metalli, così come:
- di carbonio;
- idrogeno;
- fosforo;
- silicio;
- arsenico;
- boro.
In questi casi, agisce come un agente ossidante, poiché tutti questi elementi più electropositive. Prendere in considerazione soprattutto quelle importanti.
- Disolfuro di carbonio – CS 2. Il liquido trasparente con un piacevole aroma etere. È tossico, sostanza infiammabile e che esplodono. Utilizzato come solvente, e per la maggior parte dei tipi di oli, grassi, non metalli, nitrato d'argento, resine e gomme. E 'anche una parte importante nella produzione di seta artificiale – viscosa. L'industria è sintetizzato in grandi quantità.
- L'acido solfidrico o idrogeno solforato – H 2 S. Il gas, non avendo il colore e sapore dolce. Odore forte, molto sgradevole, che ricorda di uovo marcio. Veleno, deprime il centro respiratorio collegando gli ioni di rame. Pertanto, quando si tratta di avvelenare il soffocamento e la morte. Ampiamente utilizzati in medicina, sintesi organica, la produzione di acido solforico, e materie prime energeticamente favorevole.
- solfuri metallici sono ampiamente utilizzati nella medicina, nella produzione di acido solforico, ottenendo fosfori di produzione della vernice, e in altri luoghi. formula generale – Me x S y.

Composti aventi un grado di ossidazione di +4
composti solforati 4 – è preferibilmente un ossido e corrispondenti sali e acido. Tutti loro sono composti piuttosto comuni che hanno un valore specifico nel settore. Essi possono agire come ossidanti, ma la maggior parte mostrano proprietà riducenti.
composti di zolfo formula nello stato di ossidazione +4 seguente:
- biossido di zolfo SO 2 – ossido;
- acido – solforoso H 2 SO 3;
- sali hanno la formula generale Me x (SO 3) y.
Uno dei più comuni è il biossido di zolfo, o anidride. Si tratta di una sostanza incolore avente un odore di partite bruciate. In grandi cluster formatisi durante l'eruzione dei vulcani, proprio a questo punto è facile da identificare da odore.
Esso disciolto in acqua con formazione di acido facilmente decomposizione – zolfo. Si comporta come un tipico ossido acido forme sali, che includono uno ione solfito SO 3 2-. Questo anidride – primario gas, che colpisce l'inquinamento atmosferico ambientale. Che influenza la formazione di piogge acide. Industrialmente utilizzato nella fabbricazione di acido solforico.
Composti in cui zolfo nello stato di ossidazione +6
Questi includono principalmente anidride solforica e acido solforico con i suoi sali:
- solfati;
- solfato di idrogeno.
Poiché l'atomo di zolfo è ivi nel più alto stato di ossidazione, e le proprietà di questi composti sono abbastanza spiegabile. Sono forti ossidanti.
ossidi di zolfo (VI) – triossido di zolfo – rappresenta un liquido volatile incolore. Un aspetto caratteristico – potente capacità essiccante. Ambientazione esterna fuma. Quando disciolto in acqua fornisce uno degli acidi minerali forti – solforico. La soluzione concentrata è pesante liquido oleoso leggermente giallognolo. Se l'anidride viene disciolto in acido solforico, otteniamo un particolare composto chiamato oleum. E 'utilizzato nel settore per la produzione di acido.
Tra i sali – solfato – è composti molto importanti come:
- gesso CaSO 4 · 2H 2 O;
- baryta BaSO 4;
- i sali;
- solfato di piombo e altri.
Essi vengono utilizzati in edilizia, sintesi chimica, la medicina, la fabbricazione di strumenti ottici e occhiali e anche l'industria alimentare.
Hydrogensulfates sono ampiamente utilizzati nella metallurgia, usato come un flusso. E aiutano a tradurre molte delle complesse ossidi in forma di solfato solubile che viene utilizzato nelle industrie interessate.
Lo studio di zolfo nel corso della scuola di chimica
Quando è il migliore è l'assimilazione di conoscenze da parte degli studenti che è lo zolfo, quali sono le sue proprietà, che è un composto dello zolfo? Grado 9 – il periodo migliore. Questo non è proprio all'inizio, quando i bambini tutto nuovo e strano. Questo è il mezzo per lo studio della chimica, quando le basi gettate in precedenza, contribuiranno pienamente cogliere il soggetto. Pertanto, in considerazione dei dati rilasciato è la seconda metà della classe di laurea. L'intero argomento è suddiviso in più blocchi, che sta separatamente lezione "composti di zolfo. Classe 9".
Ciò è dovuto alla loro grande numero. Anche separatamente considerato per la produzione di acido solforico nell'industria. In generale, questo tema è dato da una media di 3 ore.
Ma i composti organici di zolfo sono sottoposti allo studio solo nel 10 ° grado, quando i problemi sono considerati biologici. Anche colpiti sono e biologia al liceo. Infatti, lo zolfo è una parte di molecole organiche, come ad esempio:
- thioalcohols (tioli);
- proteine (struttura terziaria, che è la formazione di ponti disolfuro);
- tioaldeidi;
- tiofenoli;
- tioesteri;
- acido solfonico;
- solfossidi e altri.
Essi sono isolati in un gruppo separato di organosulfur composti. Sono importanti non solo nei processi biologici degli esseri viventi, ma anche nel settore industriale. Ad esempio, l'acido solfonico – la base di molti farmaci (aspirina, sulfanilamide o streptocid).
Inoltre, composti di zolfo come componente permanente alcuni:
- aminoacidi;
- enzimi;
- vitamine;
- ormoni.