Determinata dalla valenza degli elementi chimici
La conoscenza della struttura di atomi e molecole del XIX secolo non può spiegare il motivo per cui un certo numero di atomi formano legami con altre particelle. Ma le idee di scienziati in anticipo sui tempi, e la valenza di ancora in fase di studio come uno dei principi fondamentali della chimica.
Dalla storia del concetto di "valenza degli elementi chimici"
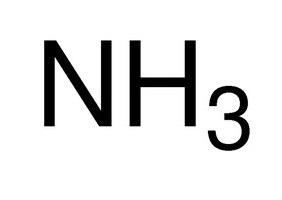
Eccezionale britannico chimico XIX secolo Edvard Franklend ha coniato il termine "comunicazione" nell'uso scientifico per descrivere l'interazione degli atomi con l'altro. Scientific notato che alcuni elementi chimici formano composti con la stessa quantità di altri atomi. Ad esempio, azoto attribuisce tre atomi di idrogeno in una molecola di ammoniaca.
Nel maggio 1852 Frankland avanza l'ipotesi che vi sia un numero specifico di legami chimici che un atomo può formare con altre particelle minuscole di materia. Frankland usato la frase "la forza di collegamento" per descrivere quello che sarebbe poi essere chiamato valenza. chimico britannico stabilito come i legami chimici formano atomi di elementi singoli noti nella metà del XIX secolo. Il lavoro Frankland era un importante contributo alla moderna chimica strutturale.

lo sviluppo di punti di vista
chimico tedesco FA Kekule dimostrato nel 1857 che il carbonio è chetyrehosnovnym. Nella sua più semplice composto – metano – derivare a 4 atomi di idrogeno. Il termine scienziato "basicità" utilizzato per indicare elementi proprietà collegano un numero fisso di altre particelle. In Russia, i dati sulla struttura della materia sistematizzata A. M. Butlerov (1861). Ulteriore sviluppo della teoria del legame chimico ottenuto attraverso gli insegnamenti della variazione periodica delle proprietà degli elementi. Il suo autore – un altro eccezionale chimico russo D. I. Mendeleev. Si è dimostrato che la valenza degli elementi chimici nei composti, e altre proprietà sono determinate dalla posizione che occupano nel sistema periodico.
 Rappresentazione grafica di valenza e chimica incollaggio
Rappresentazione grafica di valenza e chimica incollaggio
La possibilità di molecole visualizzando – uno dei meriti indubbi della teoria valenza. Il primo modello apparso nel 1860, e dal 1864 ha utilizzato formule di struttura che rappresentano marchio circonferenziale chimica all'interno. Tra i simboli atomi tratteggiate indicate legame chimico, e il numero di righe è uguale alla valenza. In quegli stessi anni, è stato realizzato il primo modello sharosterzhnevye (vedi. Foto a sinistra). Nel 1866 ha proposto Kekule modello stereochimica degli atomi di carbonio in forma di un tetraedro, che ha incluso nel suo libro di testo "Chimica Organica".
Valence degli elementi chimici, e l'emergere di rapporti studiati da G. Lewis, che ha pubblicato i suoi lavori nel 1923 dopo la scoperta dell'elettrone. La cosiddetta carica negativa minuscole particelle, che fanno parte dei gusci atomici. Nel suo libro, Lewis ha utilizzato un punto intorno ai quattro lati del simbolo chimico per la visualizzazione degli elettroni di valenza.
Valenza di idrogeno e ossigeno
Prima della creazione del sistema periodico degli valenza degli elementi chimici nei composti è stato fatto per confrontare agli atomi a cui è conosciuta. Idrogeno e ossigeno sono stati selezionati come riferimento. Un altro elemento chimico è attratto sia sostituito da un certo numero di atomi di H e O.
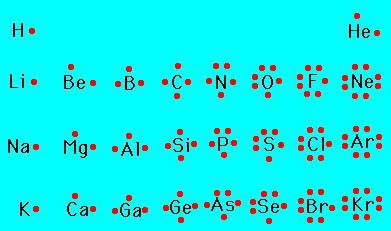
In questo modo, le proprietà sono state determinate in composti monovalenti con idrogeno (la valenza del secondo elemento è indicato con il numero romano):
- HCl – cloro (I):
- H 2 O – ossigeno (II);
- NH 3 – azoto (III);
- CH 4 – carbonio (IV).
Gli ossidi di K 2 O, CO, N 2 O 3, SiO 2, SO 3 erano determinati dalla valenza di metalli e non metalli ossigeno, raddoppiando il numero di atomi attaccabile O. Ottenuto seguenti valori: K (I), C ( II), N (III) , Si (IV), S (VI).
Come determinare la valenza degli elementi chimici
Ci sono leggi di formazione di legami chimici con le coppie di elettroni comuni:
- Tipico di idrogeno valenza – I.
- Normale ossigeno valenza – II.
- Per elementi metalloidi-inferiore valenza può essere determinato dalla formula 8 – № gruppo in cui sono nel sistema periodico. Superiore, se può essere determinato dal numero del gruppo.
- Per gli elementi laterali di sottogruppi massima valenza possibile è uguale al numero di gruppi nella tavola periodica.
Determinazione di valenza degli elementi chimici del composto di formula viene effettuata utilizzando il seguente algoritmo:
- Registrare sopra del valore chimicamente familiare noto per uno degli elementi. Ad esempio, in Mn 2 O 7 ossigeno valenza è II.
- Calcolare il valore totale, che deve essere moltiplicato per la valenza del numero di atomi di uno stesso elemento chimico nella molecola, 2 * 7 = 14.
- Determinare la valenza del secondo elemento, per il quale non si sa. Dividere ottenuto in Sez. 2 valore per il numero di atomi di Mn nella molecola.
- 14: 2 = 7. La valenza di ossido di manganese nella sua massima – VII.
valenza permanente e variabile
valori valenza di idrogeno e ossigeno sono differenti. Ad esempio, zolfo nel composto di H 2 S è bivalente, come nella formula SO 3 – esavalente. Il monossido di carbonio reagisce con l'ossigeno, CO e CO 2 diossido. Il primo composto è la valenza di C II, e nel secondo – IV. Lo stesso valore in metano CH 4.
La maggior parte degli elementi non presentano costante e variabile valenza, ad esempio, fosforo, azoto, zolfo. La ricerca delle cause principali di questo fenomeno ha portato ad una teoria di legame chimico, concetti di valenza elettroni guscio, orbitali molecolari. L'esistenza di diversi valori delle stesse proprietà ottenute con la spiegazione della struttura di atomi e molecole posizione.
le moderne concezioni di valenza
Tutti gli atomi sono composti nucleo positivo circondato da elettroni con carica negativa. Il guscio esterno, che formano, è incompleto. La struttura completata è la più stabile, contiene 8 elettroni (ottetto). legame chimico con degli accoppiamenti elettroni risultati in energeticamente favorevole condizione atomi.
Regola per la formazione di composti è il completamento di un guscio o ricevendo elettroni rinculo spaiato – a seconda che il processo è più facile passare. Se atomo prevede la formazione di un legame chimico particelle negative aventi nessuna coppia, i legami forma purché esso elettroni spaiati. Secondo concetti moderni, la valenza degli atomi di elementi chimici – è la capacità di produrre un certo numero di legami covalenti. Ad esempio, nella molecola, H 2 S di zolfo, acido solfidrico acquisisce valenza II (-), perché ogni atomo partecipa alla formazione di due coppie di elettroni. Il segno "-" indica l'attrazione della coppia di elettroni per l'elemento più elettronegativo. Almeno elettronegativo al valore di valenza aggiunge "+".
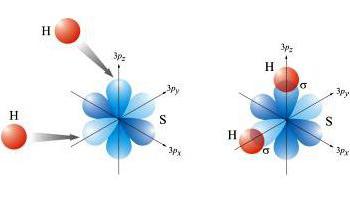
Quando meccanismo donatore-accettore sono coinvolti nel processo di coppie di elettroni di un elemento e l'altro orbitali valenza libera.
La dipendenza della valenza della struttura dell'atomo
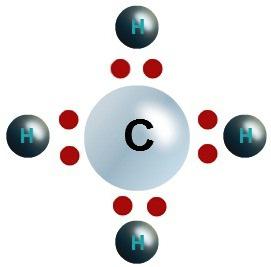
Si consideri ad esempio carbonio e ossigeno, in quanto dipende dalla struttura delle sostanze valenza degli elementi chimici. Tavola Periodica fornisce una panoramica delle caratteristiche fondamentali dell'atomo di carbonio:
- simbolo chimico – C;
- Numero articolo – 6;
- carica nucleare – 6;
- protoni nel nucleo – 6;
- elettron – 6, di cui 4 esterna, 2 dei quali formano una coppia, 2 – spaiato.
Se l'atomo di carbonio forma due legami a CO monoookside, quindi il suo uso è fornita solo 6 particelle negative. Per acquisire ottetti necessari per accoppiare 4 formate particelle negative esterne. Carbon ha una valenza di IV (+) di anidride e IV (-) a metano.
numero ordinale di ossigeno – 8, il guscio di valenza consiste di sei elettroni, due dei quali formano una coppia e sono coinvolti in legami chimici e l'interazione con altri atomi. Tipico ossigeno valenza – II (-).

Lo stato di valenza e l'ossidazione
In molti casi è più conveniente usare il termine "grado di ossidazione". Cosiddetta atomo carica quale acquisirebbe se tutti gli elettroni sono spostati all'elemento di legame, che ha un più alto valore elektroootritsatelnosti (EO). Il numero di ossidazione della sostanza semplice è zero. Con l'ossidazione più EO elemento aggiunto segno "-", meno elettronegativo – "+". Ad esempio, i principali metalli del gruppo per l'ossidazione e ione tipico oneri pari numero con il segno della "+". Nella maggior parte dei casi la valenza e stato di ossidazione degli atomi della stessa mescola numericamente coincidono. Solo quando l'interazione con più atomi elettronegativi stato di ossidazione positivo, con elementi di cui EO sotto – negativi. Il concetto di "valenza" si applica spesso solo alla sostanza della struttura molecolare.