gas di lavoro sotto isobarica, isoterme e processi adiabatici
Al centro di quasi ogni motore termico è un fenomeno termodinamico come il lavoro svolto dal gas durante l'espansione o la contrazione. Vale la pena di ricordare che in fisica al lavoro si riferisce ad una misura quantitativa, caratterizzante l'azione di alcune forze sul corpo. In conformità con il gas di lavoro, un prerequisito per l'adempimento delle quali è quello di cambiare il suo volume, non è altro che il prodotto della pressione di questa variazione di volume.

lavoro gas al cambiamento del suo volume può essere sia di carattere isobarica e isotermica. Inoltre, il processo di espansione effettiva può essere, e arbitrario. lavoro gas che viene fatto sotto espansione isobara, può essere trovato dalla seguente formula:
A = pΔV,
in cui p – caratteristica quantitativa della pressione del gas, e ΔV – differenza tra il volume iniziale e finale.
Il processo di una qualsiasi espansione del gas in fisica solito rappresentato come una sequenza di singoli processo isobara e isocora. Questi ultimi sono caratterizzati dal fatto che il gas di lavoro come i suoi indici quantitativi è zero perché non v'è alcun movimento del pistone nel cilindro. In tali condizioni, si scopre che il gas di lavoro ad un processo arbitrario varierà in proporzione diretta alla crescente volume del recipiente, in cui il movimento del pistone.
Se confrontiamo il lavoro svolto dal gas durante l'espansione e la compressione, si può notare che durante la direzione di espansione del vettore spostamento del pistone coincide con il vettore della forza di pressione del gas stesso, tuttavia nel gas di lavoro calcolo scalare è positivo e di forze esterne – negative. Quando compresso gas sotto la direzione generale di movimento del cilindro ha lo stesso vettore forza esterna, quindi il loro lavoro è il gas di lavoro positivo e negativo.
Esame del concetto di "lavoro svolto dal gas" sarebbe incompleto se non anche affetto e processi adiabatici. Sotto tale fenomeno in termodinamica si riferisce al processo in cui non v'è scambio di calore con eventuali corpi esterni. 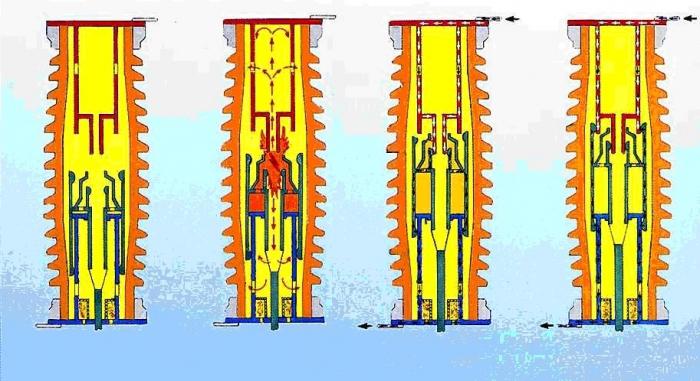 È possibile, ad esempio, nel caso in cui un recipiente con un pistone di lavoro è provvisto di un buon isolamento termico. Inoltre, la compressione del gas o processi di espansione può essere equiparata ad adiabatico se il tempo cambia di volume di gas è molto inferiore all'intervallo di tempo durante il quale si verifica l'equilibrio termico tra il gas e gli organi circostanti.
È possibile, ad esempio, nel caso in cui un recipiente con un pistone di lavoro è provvisto di un buon isolamento termico. Inoltre, la compressione del gas o processi di espansione può essere equiparata ad adiabatico se il tempo cambia di volume di gas è molto inferiore all'intervallo di tempo durante il quale si verifica l'equilibrio termico tra il gas e gli organi circostanti.
Il più comunemente incontrato nel quotidiano processo adiabatico vita può essere considerato come il lavoro del pistone nel motore a combustione interna. L'essenza di questo processo è la seguente: come sappiamo dalla prima legge della termodinamica, la variazione di energia interna del gas è quantitativamente uguale alla forza lavoro, diretta dall'esterno. Questo lavoro è nella sua direzione è positiva, e quindi l'energia interna del gas aumenta, e l'aumento di temperatura di se stesso. In tali condizioni iniziali, è chiaro che in lavorazione espansione adiabatica gas si verifica a causa della riduzione della sua energia interna, rispettivamente, la temperatura in questo processo diminuirà.













