Esperienza dispersione Rutherford di particelle alfa (breve)
Ernest Rutherford – questo è uno dei fondatori degli insegnamenti fondamentali della struttura interna dell'atomo. Lui nato scienziato in Inghilterra, in una famiglia di immigrati dalla Scozia. Rutherford era il quarto figlio nella sua famiglia, allo stesso tempo, ha dimostrato di essere il più talentuoso. Il contributo speciale avrebbe potuto fare alla teoria della struttura atomica.

idee iniziali sulla struttura dell'atomo
Va notato che prima si è tenuta famosi esperimenti di Rutherford sulla dispersione di particelle alfa, dominante in quel momento l'idea della struttura dell'atomo era il modello di Thompson. Questo scienziato era sicuro che la carica positiva si riempie uniformemente l'intero volume dell'atomo. Gli elettroni caricati negativamente, Thompson pensava, erano presumibilmente spruzzi in esso.

Prerequisiti per la rivoluzione scientifica
Dopo aver lasciato la scuola, Rutherford come l'allievo di maggior talento ha ricevuto una sovvenzione di £ 50 per la formazione continua. A causa di questo è stato in grado di andare a scuola in Nuova Zelanda. Successivamente, un giovane esami Scholar presso l'Università di Canterbury e hanno cominciato seriamente a studiare fisica e chimica. Nel 1891, Rutherford ha fatto la sua prima relazione sul tema "L'evoluzione degli elementi." E 'stato designato un'idea per la prima volta nella storia che l'atomo è una struttura complessa.
Poi dominato dall'idea di Dalton che gli atomi sono indivisibili negli ambienti scientifici. Quelli intorno a Rutherford, la sua idea sembrava abbastanza folle. Giovane scienziato aveva costantemente chiedere scusa ai colleghi per la loro "roba". Ma 12 anni dopo, Rutherford ancora è riuscito a dimostrare il loro caso. In Rutherford avuto la possibilità di continuare la sua ricerca presso il Laboratorio Cavendish in Inghilterra, dove ha iniziato a studiare i processi di ionizzazione dell'aria. La prima scoperta di Rutherford erano i raggi alfa e beta.
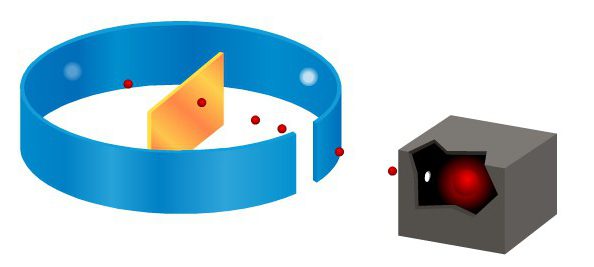
sperimentare Rutherford
Brevemente circa l'apertura può dire così: nel 1912, Rutherford ei suoi assistenti hanno avuto il suo famoso esperimento – particelle alfa emesse dalla sorgente del piombo. Tutte le particelle ad eccezione di quelli che apparivano assorbiti piombo, muovendosi lungo un canale fisso. La loro stretta flusso incidente su un sottile strato di foglio. Questa linea è perpendicolare al foglio. Esperienza Rutherford dispersione di particelle alfa dimostrato che queste particelle che passano attraverso un foglio di carta attraverso, cosiddetta scintillazione causati sullo schermo.
Questo schermo è stato rivestito con un materiale speciale che si illumina quando colpito da una particella alfa. Lo spazio tra lo strato di lamina d'oro e lo schermo è stato riempito vuoto per particelle alfa sono sparsi nell'aria. Tale dispositivo ha permesso ai ricercatori di osservare le particelle sono disperse in un angolo di 150 °.
Se la pellicola non viene utilizzato come un ostacolo ad un fascio di particelle alfa, lo schermo formò un cerchio luminoso di scintillazioni. Ma prima di mettere un fascio barriera della lamina d'oro, il quadro è cambiato. Focolaio apparso non solo al di fuori di questo cerchio, ma anche sul lato opposto del foglio. Esperienza Rutherford dispersione di particelle alfa ha mostrato che la maggior parte delle particelle passa attraverso la pellicola senza cambiamenti notevoli nella traiettoria.
Tuttavia, alcune particelle vengono deviati da un abbastanza grande angolo, e persino gettati indietro. Su ogni 10 000 liberamente passa attraverso uno strato di particelle di oro una sola lamina devia da un angolo maggiore di 10 ° – come eccezione di una delle particelle deviato in un angolo.

La ragione per le particelle alfa deviati
Quali dettagli considerato e comprovata esperienza Rutherford – struttura dell'atomo. Tale posizione indica che l'atomo non è una formazione continua. La maggior parte delle particelle passano liberamente attraverso la pellicola di spessore di un atomo. E poiché la massa di particelle alfa quasi 8000 volte più grande della massa dell'elettrone, quest'ultimo non può avere un effetto significativo sulla traiettoria di particelle alfa. Ciò può essere fatto solo da un nucleo atomico – un corpo di dimensioni ridotte, presenta quasi tutta la massa e tutta la carica elettrica dell'atomo. A quel tempo si trattava di un significativo passo avanti fisico britannico. L'esperienza di Rutherford è uno dei passi più importanti per lo sviluppo della scienza della struttura interna dell'atomo.
Altre scoperte ottenute durante lo studio dell'atomo
Questi studi sono diventati prova diretta che la carica positiva dell'atomo è nel suo nucleo. Questa regione occupa uno spazio molto piccolo rispetto alle dimensioni della sua integrità. Questo piccolo volume disperdendo particelle alfa appariva molto improbabile. Quelle particelle che passano vicino al nucleo atomico, testati deviazioni dal percorso taglienti, perché la forza repulsiva tra la particella alfa e nuclei atomici erano molto potente. esperimenti di Rutherford sulla dispersione di particelle alfa hanno dimostrato la probabilità che la particella alfa ottiene direttamente nel kernel. Tuttavia, la probabilità era molto piccola, ma non nullo.
Non era il solo fatto che è dimostrato dall'esperienza di Rutherford. Brevemente studiato la struttura dell'atomo e dei suoi colleghi, che hanno fatto un certo numero di altre importanti scoperte. Oltre ad insegnare che le particelle alfa sono nuclei di elio in rapido movimento.
Lo scienziato era in grado di descrivere la struttura dell'atomo, in cui il nucleo occupa una piccola parte del volume totale. I suoi esperimenti hanno dimostrato che praticamente l'intera carica dell'atomo è concentrata nel suo nucleo. Quando ciò si verifica entrambi i casi la deviazione di particelle alfa e casi di loro collisione con un nucleo.

Esperimenti modello nucleare di Rutherford dell'atomo
Nel 1911, Rutherford dopo numerosi studi hanno suggerito un modello di struttura atomica, che ha definito un planetario. Secondo questo modello, è disposta all'interno del nucleo dell'atomo contenente quasi tutta la massa della particella. Gli elettroni si muovono intorno al nucleo nello stesso modo come fanno i pianeti intorno al sole. Del loro set una cosiddetta nuvola di elettroni. Atomo ha anche una carica neutra, come l'esperienza di Rutherford.
La struttura di un atomo nel futuro della Concerned Scientists chiamato Niels Bohr. E 'stato lui che ha affinato la dottrina Rutherford, perché fino a quando Bohr modello planetario dell'atomo ha cominciato ad affrontare le difficoltà spiegazione. Come l'elettrone si muove attorno al nucleo in un'orbita con una certa accelerazione, prima o poi deve cadere al nucleo di un atomo. Tuttavia, Niels Bohr ha potuto dimostrare che le leggi della meccanica classica non è più attivo all'interno dell'atomo sono.













