Determinazione di atomi e molecole. Definizione di un atomo fino al 1932
A partire dal periodo antico fino alla metà del 18 ° secolo, la scienza è stata dominata da l'idea che l'atomo – una particella di materia che non può essere diviso. scienziato e naturalista inglese, e D. Dalton dato una definizione di dell'atomo come la parte più piccola di un elemento chimico. MV Lomonosov nella sua dottrina atomico e molecolare era in grado di dare una definizione del atomo e molecola. Era convinto che la molecola, che ha definito "corpuscoli", composto da "elementi" – atomi – e sono in costante movimento.
D. I. Mendeleev ritiene che questa subunità sostanze che compongono il mondo materiale, conserva tutte le sue proprietà solo se non è soggetta a divisione. In questo articolo, definiamo un oggetto come un microcosmo dell'atomo, e studiare le sue proprietà.
Sfondo della teoria della struttura atomica
Nel 19 ° secolo, è ampiamente riconosciuto come il dichiarazione sulla indivisibilità dell'atomo. Molti scienziati credevano che le particelle di un elemento chimico in tutte le circostanze non possono essere trasformati in atomi di altri elementi. Queste idee sono stati la base su cui si fonda la definizione di un atomo fino al 1932. Nel tardo 19 ° secolo nel campo della scienza sono state fatte scoperte fondamentali che hanno cambiato questo punto di vista. Prima di tutto, nel 1897 il fisico inglese Joseph John Thomson aveva scoperto l'elettrone. Questo fatto è cambiato radicalmente le idee degli scienziati sulla parte inscindibile dell'elemento chimico.
Come a dimostrare che la complessa struttura dell'atomo
Anche prima della scoperta dell'elettrone , gli scienziati concordano all'unanimità che gli atomi non hanno carica. Poi, si è constatato che gli elettroni sono facilmente distinguibili da qualsiasi elemento chimico desiderato. Essi possono essere trovati in una fiamma, sono portatori di corrente elettrica, rilasciano sostanze durante radiazioni a raggi x.

Ma se gli elettroni sono parte di tutti senza eccezione, e atomi caricati negativamente, quindi, in un atomo ci sono alcune particelle che sono sicuri di avere una carica positiva, altrimenti non sarebbero atomi elettricamente neutri. Per aiutare a rivelare la struttura dell'atomo ha aiutato un fenomeno fisico come radioattività. Ha dato la definizione corretta dell'atomo in fisica, e poi la chimica.
I raggi invisibili
Francese fisico A. Becquerel stato il primo a descrivere il fenomeno di emissione di atomi di alcuni elementi chimici, visivamente raggi invisibili. Ionizzano il passaggio dell'aria attraverso il materiale, causando annerimento lastre fotografiche. Successivamente, Curie e Rutherford trovato che sostanze radioattive si trasformano in atomi di altri elementi chimici (come l'uranio – nettunio).
radiazione radioattiva è uniforme nella composizione: particelle alfa, particelle beta, raggi gamma. Così, il fenomeno della radioattività dimostrato che la tabella periodica degli elementi particelle hanno una struttura complessa. Questo fatto ha causato le modifiche apportate alla definizione dell'atomo. Che Particelle è un atomo, data dal Rutherford ottenuto nuovi fatti scientifici? La risposta a questa domanda è stato il modello dotto nucleare proposto dell'atomo, secondo la quale gli elettroni intorno nucleo caricati positivamente muovono.
Contraddizioni modello Rutherford
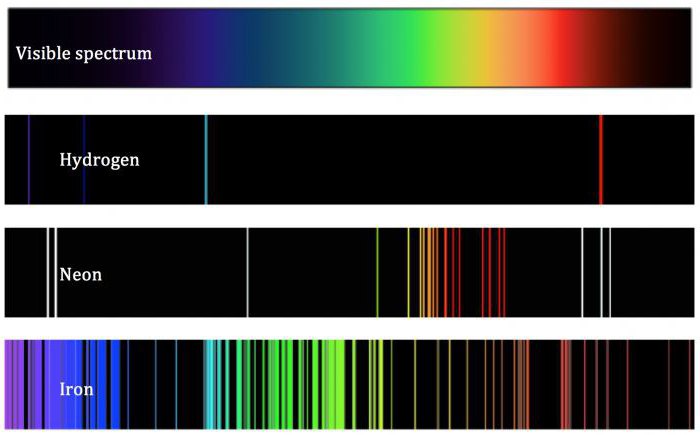
La teoria dello scienziato, nonostante il suo carattere eccezionale, non poteva oggettivamente definire l'atomo. I suoi risultati sono stati in contrasto con le leggi fondamentali della termodinamica, secondo la quale tutti gli elettroni che orbitano intorno ai nuclei perdono la loro energia e, come può essere, prima o poi devono cadere su di lui. Atomo in questo caso distrutto. Questo non è effettivamente il caso, poiché le sostanze chimiche e particelle da cui sono fatti, esistono in natura per lungo tempo. Inspiegabilmente atomo tale determinazione basato sulla teoria di Rutherford, così come il fenomeno che si verifica quando passa sostanze semplici caldi attraverso un reticolo di diffrazione. Dopo spettri atomici formata contemporaneamente avere una forma lineare. Ciò in contrasto con il modello di Rutherford dell'atomo, secondo il quale lo spettro dovrebbe essere continuo. Secondo i concetti della meccanica quantistica, gli elettroni presenti nel nucleo non sono caratterizzati come oggetti puntiformi, oltre ad avere la forma della nuvola di elettroni.

La maggior parte della sua densità in un certo luogo di spazio intorno al nucleo, ed è considerato essere la posizione di una particella in un dato momento. Inoltre, è stato trovato che l'atomo, gli elettroni sono disposti a strati. Il numero di strati può essere determinata conoscendo il numero del periodo in cui l'elemento periodica D. I. Mendeleeva sistema. Ad esempio, l'atomo di fosforo contiene 15 elettroni e ha tre livelli di energia. L'indicatore, che determina il numero di livelli di energia è chiamato numero quantico principale.
Si è stabilito sperimentalmente che il livello di energia degli elettroni, più vicina al nucleo, ha l'energia più bassa. Ciascun guscio energia è diviso in sub-livelli, e, a sua volta, sulle orbitali. Gli elettroni si trovano in differenti orbitali hanno le stesse nuvole modulo (s, p, d, f).
Sulla base di quanto precede, risulta che la forma della nube di elettroni non può essere arbitraria. È rigorosamente determinato secondo il orbitale numero quantico. Si aggiunge anche che lo stato dell'elettrone al particolato è determinata anche da due valori – magnetico e numero quantico di spin. Il primo si basa sulla Schròdinger e caratterizza l'orientamento spaziale della nuvola di elettroni sulla base della tridimensionalità del mondo. Il secondo indicatore – il numero di rotazione su esso determina la rotazione dell'elettrone attorno al suo asse o antiorario.
La scoperta del neutrone
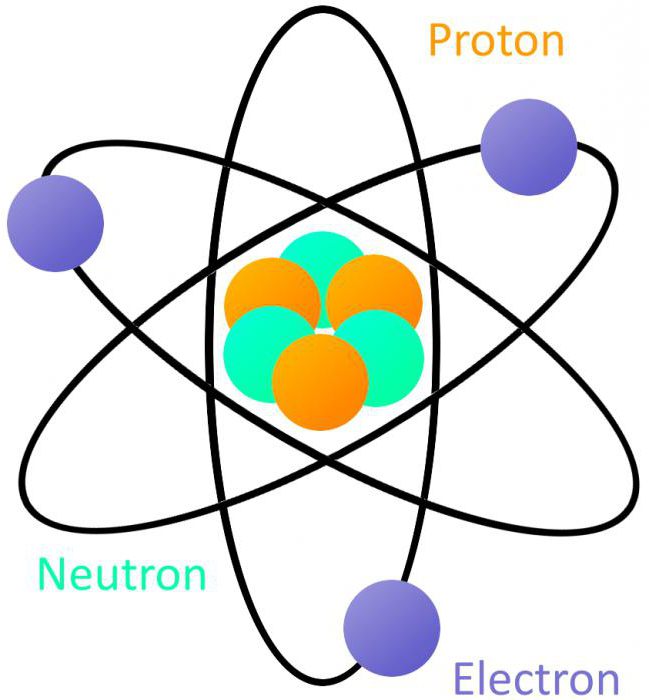
Attraverso il lavoro di D. Chadwick, le tenne nel 1932, è stato dato una nuova definizione dell'atomo in chimica e fisica. Nei loro esperimenti scientifici ha dimostrato che la scissione avviene radiazione polonium causata dalle particelle aventi nessuna carica, la massa 1,008,665 mila. Una nuova particella elementare è stato chiamato il neutrone. La sua scoperta e lo studio delle sue proprietà permesso agli scienziati sovietici V. Gapon e Ivanenko creare una nuova teoria della struttura del nucleo atomico, contenente protoni e neutroni.
Secondo la nuova teoria, determina la sostanza aveva la seguente atomo formano un'unità strutturale dell'elemento chimico, costituito da un nucleo contenente protoni, neutroni ed elettroni che si muovono intorno. Il numero di particelle positive nel nucleo è sempre uguale al numero ordinale del elemento chimico nel sistema periodico.
Successivamente professore Zhdanov nei suoi esperimenti confermato che sotto l'influenza della radiazione cosmica disco, nuclei atomici sono divisi in protoni e neutroni. Inoltre, è stato dimostrato che le forze di bloccaggio queste particelle elementari nel nucleo, è estremamente elevato consumo energetico. Essi agiscono su distanze molto brevi (dell'ordine di 10 -23 cm), chiamato nucleari. Come accennato in precedenza, da MV Lomonosov è stato in grado di dare una definizione di dell'atomo e la molecola sulla base di riscontri scientifici a lui noti.

Attualmente riconosciuto considerare il seguente modello: atomo è costituito da un nucleo e gli elettroni che si muovono in un percorsi rigorosamente definiti – orbitali. Gli elettroni allo stesso tempo mostrano le proprietà di entrambi particelle e onde, cioè avere una duplice natura. Il nucleo di un atomo è concentrata quasi tutta la sua massa. È costituita da protoni e neutroni associate alle forze nucleari.
Se è possibile pesare atomo
Si scopre che ogni atomo ha massa. Ad esempio, è di idrogeno 1,67h10 -24 è stato anche difficile immaginare quanto piccolo questo valore. Per trovare il peso dell'oggetto, non utilizzare le scale, e l'oscillatore, che è un nanotubo di carbonio. Per calcolare il peso dell'atomo e la molecola più conveniente quantità è il peso relativo. Mostra quante volte il peso di una molecola o un atomo più 1/12 dell'atomo di carbonio, che è 1,66h10 -27 kg. masse atomiche relative sono riportati nella tabella periodica degli elementi chimici, e non hanno dimensione.
Gli scienziati sono consapevoli che il peso atomico di un elemento chimico – è il numero medio di massa di isotopi. Sembra, nella natura di un'unità di un elemento chimico può avere masse differenti. Così le cariche dei nuclei di tale particella strutturale stessi.
Gli scienziati hanno scoperto che gli isotopi differiscono nel numero di neutroni nel nucleo e nuclei li caricano identici. Ad esempio, un atomo di cloro, avente una massa 35 conteneva 18 neutroni e 17 protoni, e con una massa di 37 – 20 protoni e 17 neutroni. Molti elementi chimici sono miscele di isotopi. Ad esempio, sostanze semplici come il potassio, argon, ossigeno contenuto nei suoi atomi composizione rappresentano 3 isotopo differente.
Determinazione della atomicità
Ha diverse interpretazioni. Considerare ciò che si intende con questo termine in chimica. Se gli atomi di un elemento chimico possono esistere almeno temporalmente isolatamente, non tende a formare particelle più complesse – molecole, allora si dice che tali sostanze hanno una struttura atomica. Ad esempio, a più stadi reazione di clorurazione del metano. È ampiamente usato in chimica organica sintetica per i principali alogeno derivati: diclorometano, tetracloruro di carbonio. Si contempla molecole di cloro ad atomi aventi elevata reattività. Distruggono legami sigma nella molecola del metano, fornendo una reazione di sostituzione catena.
Un altro esempio di un processo chimico avente grande importanza nel settore – l'uso di perossido di idrogeno come agente disinfettante e sbiancante. Determinazione dell'ossigeno atomico come un prodotto di scissione del perossido di idrogeno si verifica in entrambe le cellule vive (dall'enzima catalasi), e in laboratorio. ossigeno atomico qualitativamente determinata dalle sue elevate proprietà antiossidanti e la loro capacità di distruggere gli agenti patogeni: batteri, funghi e loro spore.

Come l'involucro nucleare
Abbiamo precedentemente trovato che l'unità strutturale di un elemento chimico ha una struttura complessa. Attorno alle particelle di nucleo caricati positivamente ruotano elettroni negativi. Il premio Nobel Niels Bohr, basato sulla teoria dei quanti di luce, creò un insegnamento, in cui la caratterizzazione e identificazione di atomi sono i seguenti: elettroni che si muovono attorno al nucleo solo in determinati percorsi obbligati in questo caso non irradiare energia. Bohr, gli scienziati hanno dimostrato che le particelle del micromondo, che comprendono atomi e molecole non obbedire alle leggi vigenti per i corpi di grandi dimensioni – oggetti macrocosmo.
La struttura dei gusci di elettroni di particolato è stato studiato in pubblicazioni su scienziati di fisica quantistica, come Hund, Pauli Klechkovskii. Poiché si è saputo che gli elettroni fanno il moto di rotazione attorno al nucleo non è caotico, ma su alcuni percorsi fissi. Pauli riscontrato che all'interno di un unico livello di energia a ciascuno dei suoi orbitali s, p, d, f in cellule elettronici possono essere non più di due particelle cariche negativamente di valore opposto rotazione + ½ e – ½.
regola di Hund ha spiegato come riempire orbitali degli elettroni con lo stesso livello di energia.
Principio Aufbau, chiamato anche la regola n + l, spiegano come orbitali riempito multielettronici atomi (elementi 5, 6, 7 cicli). Tutte le regolarità sopra servito come la base teorica degli elementi chimici creati da Dmitriem Mendeleevym.
grado di ossidazione
È un concetto fondamentale in chimica e descrive lo stato di un atomo in una molecola. La moderna definizione del grado di ossidazione degli atomi è il seguente: la carica viene condizionato atomi nella molecola, che viene calcolata usando i concetti che una molecola contiene solo la composizione ionica.
L'ossidazione può essere espresso da un numero intero oppure un numero frazionario, a valori positivi, negativi o nulli. Nella maggior atomi di elementi chimici hanno diversi stati di ossidazione. Ad esempio, l'azoto è -3, -2, 0, +1, +2, +3, +4, +5. Ma tale elemento, come fluoro, in tutte le sue composti possiede un singolo stato di ossidazione pari a -1. Se è presentata una sostanza semplice, il suo stato di ossidazione zero. Questo prodotto chimico quantitativi comodo da utilizzare per la classificazione delle sostanze e per descrivere le loro proprietà. Nella maggior parte dei casi, il grado di ossidazione della chimica utilizzata nella creazione di reazioni equazioni redox.
Le proprietà degli atomi
Grazie alle scoperte della fisica quantistica, la moderna definizione di dell'atomo, che si basa sulla teoria Ivanenko e Gapon E, integrato dai seguenti fatti scientifici. La struttura di un nucleo atomico non viene modificato durante le reazioni chimiche. La modifica riguarda solo orbitali elettronici stazionari. La loro struttura può essere attribuito a un sacco di proprietà fisiche e chimiche delle sostanze. Se l'elettrone lascia un'orbita stazionaria e procede ad orbitale con una maggiore energia tale atomo è chiamato eccitato.

Va notato che gli elettroni non possono essere un lungo tempo su questi orbitali non core. Tornando alla sua orbita stazionaria, l'elettrone emette il quanto di energia. Lo studio di tali caratteristiche delle unità strutturali di elementi chimici come affinità elettronica, elettronegatività, energia di ionizzazione, ha permesso agli scienziati non solo per definire l'atomo come un microcosmo essenziale particella, ma anche permesso loro di spiegare la capacità di atomi per formare uno stato molecolare stabile e energeticamente più favorevole della materia, una possibile conseguenza di creare qualsiasi tipo di legami chimici stabili: ionico, covalente polare e apolari, donatore-accettore (come specie di legame covalente) em etallicheskoy. Quest'ultima determina i più importanti proprietà fisiche e chimiche dei metalli.
È stato accertato sperimentalmente che la dimensione di un atomo può variare. Tutto dipenderà la molecola in cui è incluso. Attraverso-analisi diffrattometrica può calcolare la distanza tra gli atomi in un composto chimico, così come imparare raggio unitario elemento strutturale. Possedere modelli di cambiamento dei raggi delle atomi contenuti nel periodo o gruppo di elementi chimici, è possibile prevedere le loro proprietà fisiche e chimiche. Ad esempio, in periodi con crescente nucleo atomico carica loro diminuzione radio ( "atomo compressione"), e quindi indeboliscono le proprietà metalliche dei composti, e non metallica amplificati.
Così, la conoscenza della struttura dell'atomo può determinare con precisione le proprietà fisiche e chimiche di tutti gli elementi inclusi nel sistema periodico degli elementi.









