Tipi di proteine, funzioni e strutture
Secondo la teoria della vita Oparin-Haldane sul nostro pianeta è nata dalle goccioline coacervato. E 'stato anche una molecola proteica. Cioè, si può concludere che queste sostanze chimiche – la base di tutta la vita che esiste oggi. Ma cosa fa un rappresentano strutture di proteine? Che ruolo giocano nel corpo e della vita delle persone? Quali tipi di proteine esistono? Cerca di capire.
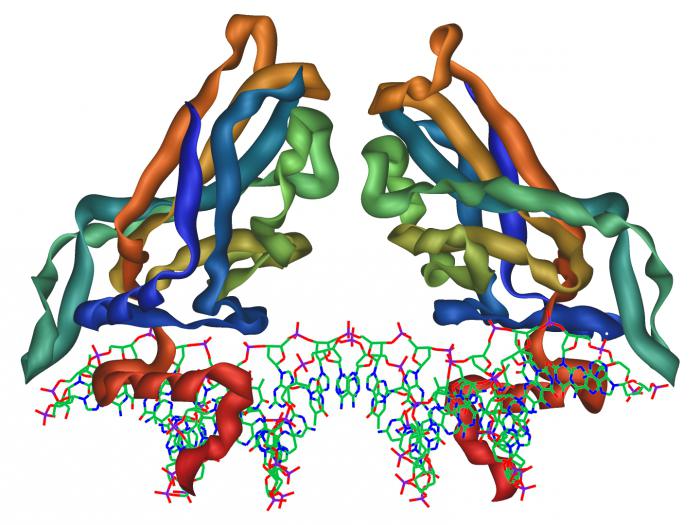
Proteine: concetto generale
Dal punto di vista della struttura chimica, molecola della sostanza in questione è una sequenza di aminoacidi legati insieme da legami peptidici.
Ogni amminoacido ha due gruppi funzionali:
- carbossi-COOH;
- un gruppo amminico -NH 2.
E fra di essi ed è formata nella connessione di molecole diverse. Così il legame peptidico ha la forma -CO-NH. molecola proteica può contenere centinaia o migliaia di questi gruppi, che dipenderà dalla particolare sostanza. Tipi di proteine sono molto diverse. Tra loro ci sono quelli che contengono gli aminoacidi essenziali per il corpo, e quindi deve essere ingerita con il cibo. Ci sono alcune specie che hanno funzioni importanti nella membrana cellulare e il suo citoplasma. Catalizzatori producono anche natura biologica – enzimi, che sono anche molecole proteiche. Essi sono ampiamente utilizzati nella vita umana, e non solo coinvolti nei processi biochimici degli esseri viventi.
Il peso molecolare dei composti in questione può variare da poche decine a milioni. Poiché il numero di unità monomeriche nella catena polipeptidica infinitamente grande e dipende dal tipo di sostanza specifica. La proteina nella sua forma pura, nella sua conformazione nativa, può essere visto quando si considera l'uovo nella sua forma grezza. spessa massa colloidale giallo chiaro trasparente, che si trova all'interno del tuorlo – è la sostanza desiderata. Lo stesso si dice circa la ricotta non grasso, questo prodotto è anche quasi puro di proteine nella sua forma naturale.
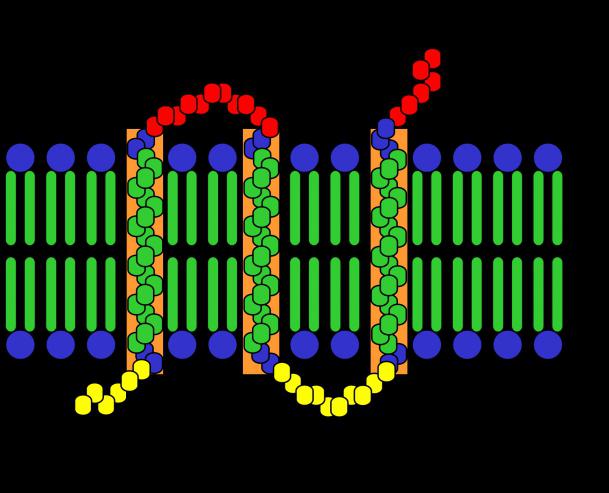
Tuttavia, non tutti i composti in oggetto hanno la stessa struttura spaziale. In totale ci sono quattro organizzazioni molecola. Tipi di strutture proteiche determinate dalle sue proprietà e parlare di complessità strutturale. Sappiamo anche che più spazialmente molecole complesse sottoposti a trattamento rigoroso nell'uomo e negli animali.
Tipi di strutture proteiche
In totale ci sono quattro. Prendere in considerazione ciò che costituisce ciascuno di essi.
- Primaria. Si tratta di una sequenza lineare convenzionale di aminoacidi legati da legami peptidici. Non ci sono colpi di scena spaziali, senza elica. Il numero di link in entrata al polipeptide può essere fino a diverse migliaia. Tipi di proteine con struttura simile – glitsilalanin, l'insulina, l'istone, elastina, e altri.
- Secondario. Esso comprende due catene polipeptidiche che sono intrecciati elicoidalmente e sono orientate verso l'altra spire formate. Quindi tra loro verificarsi legami idrogeno che li tiene insieme. Così si forma una singola molecola proteica. Forme di questo tipo i seguenti proteine: lisozima, pepsina e altri.
- conformazione terziaria. È un compatto densamente raccolte nella struttura secondaria della bobina. Qui, ci sono altri tipi di interazione, oltre a legami idrogeno – questo è l'interazione Waals van der e le forze di attrazione elettrostatiche, contatto idrofilo-idrofobo. Esempi di strutture – albumina, la proteina fibroina di seta e altri.
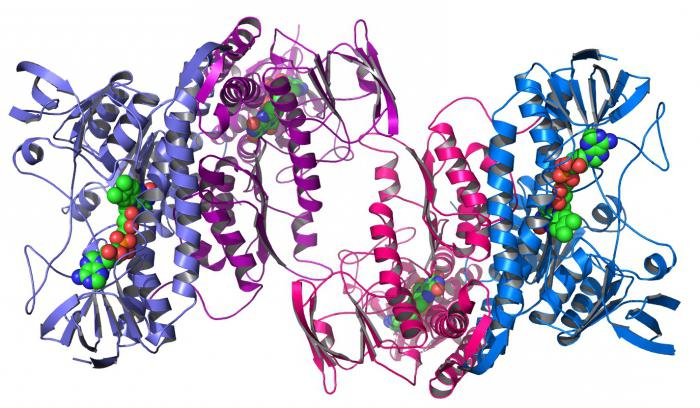
- Quaternario. La struttura più complessa, che è catene polipeptidiche più intrecciati in una spirale, arrotolato in una palla e combinati insieme in un globulo. Esempi quali insulina, ferritina, emoglobina, collagene, illustrano proprio una tale conformazione delle proteine.
Se consideriamo tutti i dettagli della struttura molecolare da un punto di vista chimico, l'analisi richiede molto tempo. Dopo tutto, infatti, maggiore è la configurazione, il più difficile e confondere la sua struttura, i più tipi di interazioni osservate nella molecola.

Denaturazione delle molecole proteiche
Una delle più importanti proprietà chimiche dei polipeptidi è la loro capacità di abbattere sotto l'influenza di determinate condizioni o agenti chimici. Ad esempio, diffusi diversi tipi di denaturazione delle proteine. Che cosa è questo processo? Egli è la distruzione della struttura proteica nativa. Cioè, se la molecola originale aveva una struttura terziaria, dopo l'azione di agenti speciali sarà distrutto. Tuttavia, la sequenza dei residui di amminoacidi nella molecola rimane intatto. proteine denaturate sono rapidamente perdendo le loro proprietà fisiche e chimiche.
Ciò che gli agenti possono portare al processo di distruzione della conformazione? Ci sono diversi.
- Temperatura. In seguito a riscaldamento, una graduale degradazione della struttura secondaria terziaria quaternaria,, della molecola. Visivamente, è possibile osservare, per esempio, un convenzionale friggere un uovo. La risultante "proteina" – una struttura primaria di albumina polipeptide, che è stato nel prodotto grezzo.
- Radiazioni.
- L'azione di forti agenti chimici: acidi, basi, sali, metalli pesanti, solventi (ad esempio, alcoli, eteri, benzene e altri).
Questo processo è talvolta chiamato molecola di fusione. Tipi di denaturazione delle proteine dipendono dall'agente, la cui azione si è verificato. Allo stesso tempo, in alcuni casi v'è un processo inverso di considerazione. Questo rinaturazione. Non tutte le proteine sono in grado di ripristinare di nuovo alla sua struttura, ma gran parte di essa può farlo. Così, i chimici provenienti da Australia e gli Stati Uniti hanno attuato la rinaturazione di uova di gallina bollita con l'aiuto di alcuni dei reagenti e il metodo di centrifugazione.
Questo processo è importante per gli organismi viventi nella sintesi di polipeptidi catene rRNA e ribosomi nelle cellule.

L'idrolisi della molecola proteica
Pari con la denaturazione delle proteine caratteristiche di un'altra proprietà chimico – idrolisi. Questa è anche la distruzione della conformazione nativa, ma non per la struttura primaria, ed è completamente fino ai singoli amminoacidi. Una parte importante della digestione – l'idrolisi delle proteine. Tipi di idrolisi dopo polipeptidi.
- Chemical. Sulla base l'azione di acidi o alcali.
- Biologici o enzimatica.
Tuttavia, l'essenza del processo rimane invariato e non dipende da quali tipi di idrolisi delle proteine si svolgono. Come si formano a seguito di amminoacido, che sono trasportati da tutte le cellule, organi e tessuti. Loro ulteriore trasformazione comporta la partecipazione della sintesi di nuovi polipeptidi, ha quelli organismo specifico richiesto.
Nell'industria, il processo di idrolisi molecole proteiche viene utilizzata come tempo per ottenere amminoacidi desiderati.
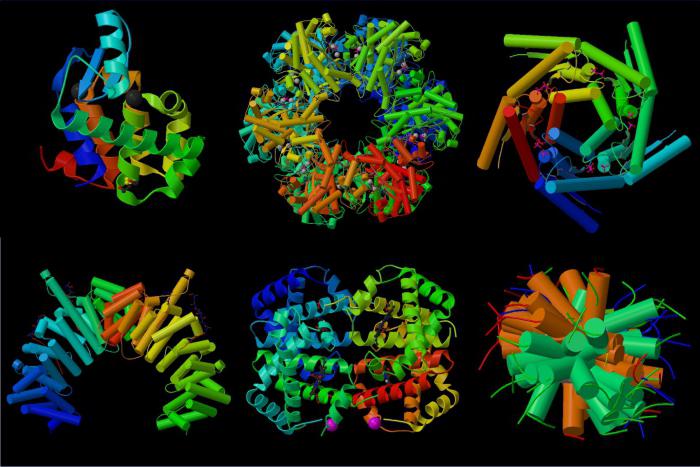
La funzione delle proteine nel corpo
Diversi tipi di proteine, carboidrati, grassi sono componenti essenziali per la vita normale di una cella. E questo significa che l'intero organismo. Pertanto, per molti aspetti il loro ruolo si spiega con l'elevato grado di importanza e ubiquità all'interno di esseri viventi. Ci sono diverse funzioni di base delle molecole polipeptidiche.
- Catalitica. Viene effettuata enzimi che hanno una natura proteica della struttura. Su di loro dirà più tardi.
- Struttura. Tipi di proteine e le loro funzioni nel corpo colpiscono soprattutto la struttura della cella stessa, la sua forma. Inoltre, i polipeptidi in questo ruolo, formano i capelli, unghie, gusci di molluschi, piume di uccello. Sono alcune valvole nel corpo cellulare. Cartilagine consiste anche di questi tipi di proteine. Esempi: tubulina, la cheratina, actina, e altri.
- Regolamentazione. Questa caratteristica si manifesta nella partecipazione di polipeptidi in processi come trascrizione, traduzione, ciclo cellulare, splicing, mRNA e altre letture. Tutti svolgono un importante ruolo di regolatore.
- Segnale. Questa funzione è svolta da proteine localizzate sulla membrana cellulare. Essi trasmettono segnali diversi da un'unità all'altra, e questo porta ad un tessuto posto insieme. Esempi: citochine, insulina, fattori di crescita, e altri.
- Trasporti. Alcuni tipi di proteine e delle loro funzioni che essi svolgono, sono semplicemente vitale. Ciò avviene, ad esempio, la proteina emoglobina. Trasporta trasporto di ossigeno da cellula a cellula nel sangue. è indispensabile per gli esseri umani.
- Sostituzione o di backup. Tali polipeptidi accumulano in piante e animali come fonte di ovociti alimentazione supplementare ed energia. Esempio – globuline.
- Motore. Una caratteristica molto importante, soprattutto per i protozoi e batteri. Dopo tutto, essi sono in grado di muoversi solo con l'aiuto di flagelli o cilia. E questi organelli è intrinsecamente niente come le proteine. Esempi di tali polipeptidi sono i seguenti: miosina, actina, chinesina, e altri.
E 'ovvio che la funzione delle proteine nel corpo umano e gli altri esseri viventi sono molto numerose e importanti. Questo conferma ancora una volta che senza collegamenti non può essere considerato da noi, la vita sul nostro pianeta.
La funzione di protezione delle proteine
Polipeptidi possono proteggere contro le diverse influenze: chimici, fisici e biologici. Ad esempio, se il corpo sarebbe minacciata come un virus o un batterio con la natura estera, le immunoglobuline (anticorpi) vengono a loro "nella lotta", l'esecuzione di un ruolo protettivo.
Se parliamo di effetti fisici, v'è un grande gioco di ruolo, per esempio, la fibrina e fibrinogeno, che sono coinvolti nella coagulazione del sangue.
proteine alimentari
Tipi di proteine nella dieta sono i seguenti:
- pieno – quelli che contengono tutti gli aminoacidi essenziali;
- difettosi – quelli in cui v'è una composizione aminoacidica parziale.
Tuttavia, per il corpo umano sono importanti e quelli e altri. Soprattutto il primo gruppo. Tutti, in particolare durante i periodi di intenso sviluppo (infanzia e adolescenza) e la pubertà deve mantenere un livello costante di proteine in sé. Dopo tutto, abbiamo già le funzioni che svolgono queste molecole stupefacenti coperti, e sappiamo che quasi nessun processo, nessuna reazione biochimica dentro di noi non può fare a meno della partecipazione dei polipeptidi.
Ecco perché è necessario ogni giorno per consumare il fabbisogno giornaliero di proteine, che sono contenute nei seguenti prodotti:
- uova;
- latte;
- ricotta;
- carne e pesce;
- fagioli;
- semi di soia;
- fagioli;
- arachidi;
- di grano;
- avena;
- lenticchie e altri.
Se si consumano ogni giorno 0,6 g polipeptide per kg di peso corporeo, allora la persona non sarà mai una carenza di questi composti. Se un tempo il corpo non riceve le proteine necessarie, si verifica la malattia, una morte per fame aminoacido chiamato. Questo porta a disturbi metabolici gravi e, di conseguenza, molti altri disturbi.
Le proteine nella cellula
All'interno, la più piccola unità strutturale di tutte le cose viventi – cellule – sono anche le proteine. E lo fanno quasi tutto quanto sopra di funzionare. Principalmente formare celle citoscheletro costituito da microtubuli, microfilamenti. Serve a mantenere la forma, nonché per il trasporto tra organelli all'interno. Per molecole proteiche, entrambi i canali o guide, spostare vari ioni, composti.
L'importante ruolo delle proteine incorporato nella membrana e si trova sulla sua superficie. Qui sono e recettore e segnalazione sono svolte, partecipano alla costruzione della membrana stessa. Fanno la guardia, e quindi svolgere un ruolo protettivo. Che tipo di proteine nella cellula può essere attribuito a questo gruppo? Ci sono molti esempi, diamo alcuni.
- Actina e miosina.
- Elastina.
- Cheratina.
- Collagene.
- Tubulina.
- Emoglobina.
- Insulina.
- Transcobalamin.
- Transferrina.
- Albumina.
In tutto ci sono centinaia di diversi tipi di proteine, che sono costantemente in movimento all'interno di ogni cellula.
Tipi di proteine nel corpo
Essi sono, naturalmente, una varietà enorme. Se proviamo a dividere in qualche modo tutte le proteine esistenti in gruppi, si può girare intorno ad una tale classificazione.
- proteine globulari. È quelli rappresentati dalla struttura terziaria, cioè globulo densamente. Esempi di tali strutture sono: immunoglobuline, la maggior parte degli enzimi, molti ormoni.
- proteine fibrillari. Rappresentano filamenti rigorosamente ordinate aventi corretta simmetria spaziale. Questo gruppo di proteine includono la struttura primaria e secondaria. Ad esempio, la cheratina, collagene, tropomiosina, fibrinogeno.
In generale, si può prendere come base il set di attributi per la classificazione delle proteine presenti nel corpo. Singolo non esiste ancora.
enzimi
catalizzatori biologici di natura proteica, che accelera tutti i processi biochimici che si verificano. Normale scambio di sostanze semplicemente non essere possibile senza questi composti. Tutti i processi di sintesi e di guasto, l'assemblaggio di molecole e la loro replicazione, trascrizione e traduzione, e altri sono svolti sotto l'influenza della forma specifica dell'enzima. Esempi di queste molecole sono:
- ossidoreduttasi;
- transferasi;
- catalasi;
- idrolasi;
- isomerasi;
- liasi e altri.
Oggi, gli enzimi vengono utilizzati nella vita quotidiana. Ad esempio, nella produzione di detersivi vengono spesso utilizzati cosiddetti enzimi – che ci sono catalizzatori biologici. Migliorano la qualità del lavaggio a temperature specificate. È facile legarsi a particelle di sporco e rimuoverli dalla superficie dei tessuti.
Tuttavia, a causa della natura degli enzimi proteina non può tollerare acqua troppo calda o vicinanza dal alcalini o sostanze acide. Infatti, in questo caso, si verifica il processo di denaturazione.