Il sistema periodico di Mendeleev e la legge periodica
Durante il diciannovesimo secolo, molte direzioni, compresa la chimica, hanno subito una forte riforma. Il sistema periodico di Mendeleev, formulato nel 1869, ha portato a una comprensione unitaria della dipendenza della posizione di sostanze semplici nella tavola periodica, che ha stabilito il rapporto tra la massa atomica relativa, la valenza e la proprietà dell'elemento.
Domedeleevsky periodo di chimica
Un po 'prima, agli inizi del diciannovesimo secolo, furono ripetuti tentativi di sistematizzare gli elementi chimici. Il chimico tedesco Döbereiner ha condotto il primo lavoro serio sulla sistematizzazione nel campo della chimica. Ha stabilito che un certo numero di sostanze simili per proprietà possono essere combinate in gruppi – triadi.
L'erroneità delle opinioni dello scienziato tedesco
L'essenza della legge presentata delle triade Döbereiner è stata determinata dal fatto che la massa atomica della sostanza ricercata è vicina alla mezza somma (media dei valori) delle masse atomiche degli ultimi due elementi della tavola di triade. 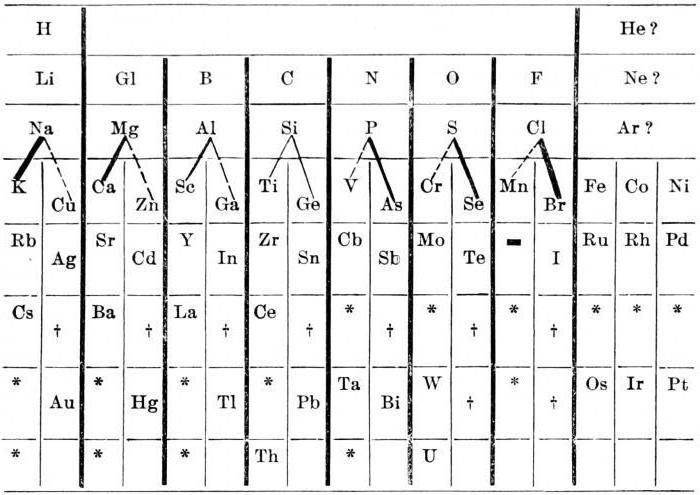 Tuttavia, l'assenza di magnesio in un unico sottogruppo di calcio, stronzio e bario era erroneo.
Tuttavia, l'assenza di magnesio in un unico sottogruppo di calcio, stronzio e bario era erroneo.
Questo approccio era una conseguenza della restrizione artificiale di sostanze simili solo sindacati tripartiti. Döbereiner ha visto bene la somiglianza nei parametri chimici del fosforo e dell'arsenico, del bismuto e dell'antimonia. Tuttavia, si limitò a trovare triadi. Di conseguenza, non poteva arrivare alla corretta classificazione degli elementi chimici.
Per dividere gli elementi esistenti in triadi, Döbereiner certamente non è riuscito, la legge chiaramente indicava la presenza del rapporto tra la massa atomica relativa e le proprietà delle sostanze chimiche semplici.
Il processo di sistematizzazione degli elementi chimici
Tutti i successivi tentativi di sistematizzazione si sono basati sulla distribuzione degli elementi a seconda della loro massa atomica. Più tardi, l'ipotesi Döbereiner fu utilizzata da altri chimici. Appare la formazione di triad, tetrad e pentad (raggruppandosi in tre, quattro e cinque elementi).
Nella seconda metà del diciannovesimo secolo comparvero parecchie opere su cui Dmitry Ivanovich Mendeleyev portò la chimica alla completa sistematizzazione degli elementi chimici. Un'altra struttura del sistema periodico di Mendeleyev ha portato ad una comprensione rivoluzionaria e all'evidente meccanismo di distribuzione di sostanze semplici.
Sistema periodico di elementi Mendeleev
In una riunione della comunità chimica russa nella primavera del 1869 è stato inviato un avviso allo scienziato russo DI Mendeleyev sulla scoperta di una legge periodica di elementi chimici.  Alla fine dello stesso anno è stata pubblicata la prima opera "Fondamenti di chimica", incluso il primo sistema periodico di elementi.
Alla fine dello stesso anno è stata pubblicata la prima opera "Fondamenti di chimica", incluso il primo sistema periodico di elementi.
Nel novembre del 1870, mostrò ai colleghi l'aggiunta del "Sistema Naturale degli Elementi e del suo uso per indicare le qualità di elementi sconosciuti". In questo lavoro DI Mendeleyev ha usato il termine "legge periodica". Il sistema degli elementi di Mendeleev sulla base della legge periodica ha determinato la possibilità dell'esistenza di sostanze semplici non aperte e chiaramente indicato le loro proprietà.
Correzioni e chiarimenti
Di conseguenza, nel 1971, la legge periodica e il sistema periodico degli elementi di Mendeleev furono raffinati e completati da un chimico russo.
Nell'articolo finale "Validità periodica degli elementi chimici", lo scienziato ha stabilito la definizione di una legge periodica che afferma che le caratteristiche dei corpi semplici, delle proprietà dei composti e dei complessi corpi formati da loro sono determinati dalla dipendenza diretta in base al loro peso atomico.
Un po 'più tardi, nel 1872, la struttura del sistema periodico di Mendeleyev è stata riorganizzata in una forma classica (modalità di distribuzione a breve termine). 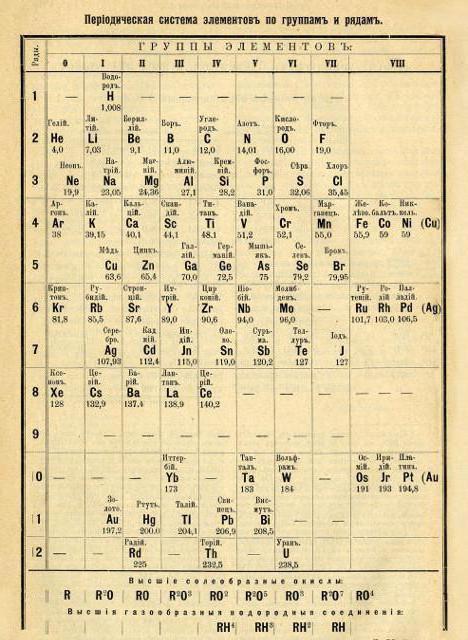
A differenza dei suoi predecessori, il chimico russo ha fatto un tavolo in pieno, ha introdotto il concetto di regolarità del peso atomico degli elementi chimici.
Le caratteristiche degli elementi del sistema periodico di Mendeleev e delle regolarità derivate permettevano allo scienziato di descrivere le proprietà degli elementi che non sono stati ancora scoperti. Mendeleev si è basata sul fatto che le proprietà di ciascuna sostanza possono essere determinate in base alle caratteristiche di due elementi vicini. Lo chiamò la regola della "stella". La sua essenza sta nel fatto che nella tabella degli elementi chimici per determinare le proprietà dell'elemento selezionato, è necessario orientare orizzontalmente e verticalmente nella tabella degli elementi chimici.
Il sistema periodico di Mendeleev è in grado di prevedere …
La tabella degli elementi di Mendeleev, nonostante la sua precisione e fedeltà, non è stata completamente riconosciuta dalla comunità scientifica. Alcuni grandi studiosi di fama mondiale hanno ridicolizzato apertamente la possibilità di prevedere le proprietà di un elemento sconosciuto. E solo nel 1885, dopo la scoperta degli elementi previsti – ekaalumina, ekabor e ekasilicia (gallium, scandium e germanio), il nuovo sistema di classificazione di Mendeleev e la legge periodica furono riconosciuti come base teorica della chimica.
All'inizio del Novecento, la struttura del sistema periodico di Mendeleyev è stata ripetutamente corretta. Nel processo di ottenimento di nuovi dati scientifici, Mendeleev e il suo collega U. Ramsay hanno concluso che era necessario introdurre un gruppo zero. Esso comprendeva gas inerti (elio, neon, argon, krypton, xeno e radon).
Nell'anno diciannovesimo, F. Soddy ha proposto di mettere elementi chimici indesiderabili – isotopi – in una sola cella del tavolo.
Nel processo di lavoro lungo e minuzioso, la tavola periodica degli elementi chimici di Mendeleyev è stata finalizzata e ha acquisito un aspetto moderno. Esso comprendeva otto gruppi e sette periodi. I gruppi sono colonne verticali, i periodi sono orizzontali. In gruppi è definita la suddivisione in sottogruppi. 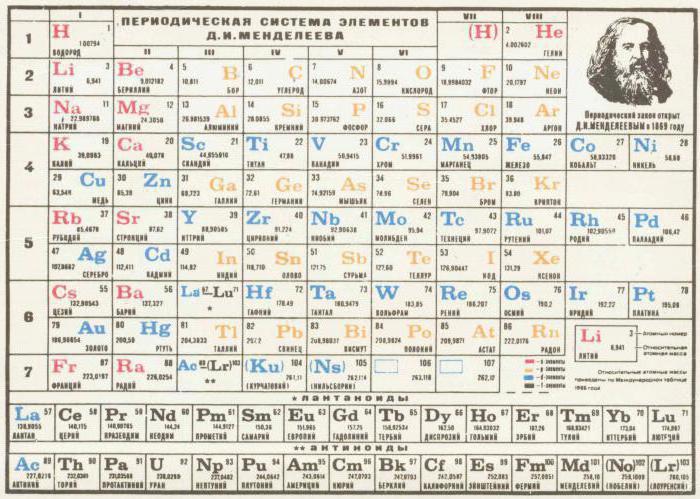
La posizione dell'elemento nella tabella indica la sua valenza, puramente gli elettroni e le caratteristiche chimiche. Come è risultato più tardi, durante lo sviluppo della tabella, Mendeleev trovò una coincidenza casuale del numero di elettroni di un elemento con il suo numero di serie.  Questo fatto semplifica ulteriormente la comprensione del principio dell'interazione di sostanze semplici e la formazione di sostanze complesse. E anche il processo in senso opposto. Il calcolo della quantità di sostanza ottenuta, così come quella necessaria per la reazione chimica per procedere, è diventata teoricamente disponibile.
Questo fatto semplifica ulteriormente la comprensione del principio dell'interazione di sostanze semplici e la formazione di sostanze complesse. E anche il processo in senso opposto. Il calcolo della quantità di sostanza ottenuta, così come quella necessaria per la reazione chimica per procedere, è diventata teoricamente disponibile.
Il ruolo della scoperta di Mendeleev nella scienza moderna
Il sistema Mendeleev e il suo approccio all'ordinazione di elementi chimici hanno predeterminato l'ulteriore sviluppo della chimica. Grazie a una corretta comprensione del rapporto tra costanti chimiche e analisi, Mendeleev è riuscito a raggruppare e raggruppare correttamente gli elementi secondo le loro proprietà.  Una nuova tabella di elementi consente di calcolare con precisione e precisione i dati prima dell'inizio della reazione chimica, per prevedere nuovi elementi e le loro proprietà.
Una nuova tabella di elementi consente di calcolare con precisione e precisione i dati prima dell'inizio della reazione chimica, per prevedere nuovi elementi e le loro proprietà.
La scoperta dello scienziato russo ha avuto un impatto diretto sull'ulteriore sviluppo della scienza e della tecnologia. Non esiste un'area tecnologica che non implica la conoscenza della chimica. Forse, se una tale scoperta non avesse avuto luogo, la nostra civiltà avrebbe seguito un diverso percorso di sviluppo.














