Reazioni di sostituzione: descrizione, esempi equazione
Molti reazione di sostituzione apre la strada alla preparazione di vari composti aventi un'applicazione di utilità. Un ruolo enorme nel campo della scienza chimica e l'industria è dato sostituzione elettrofila e nucleofila. In sintesi organica, questi processi hanno una serie di caratteristiche che devono essere conosciute.
Una varietà di fenomeni chimici. reazione di sostituzione
cambiamenti chimici associati con la trasformazione della materia, una serie di caratteristiche diverse. Può essere diversi risultati, effetti termici; alcuni processi stanno per finire, si tratta in altre equilibrio chimico. agenti modificatori è spesso accompagnata aumentando o diminuendo il grado di ossidazione. Nella classificazione di fenomeni chimici nei loro risultati finali attirare l'attenzione sulle differenze qualitative e quantitative tra i reagenti dai prodotti. Queste caratteristiche possono essere distinti 7 tipi di reazioni chimiche, compreso lo scambio, procedendo secondo lo schema: A-B-C A + C + B. La registrazione semplificata di un'intera classe di fenomeni chimico dà un'idea che tra i materiali di partenza è il cosiddetto "malintenzionato "sostituente particelle nell'atomo reagente, ione gruppo funzionale. La reazione di sostituzione è caratteristica di saturi e idrocarburi aromatici.
reazione di sostituzione può avvenire in forma di doppio scambio: A-B-C + E C + A-B-E. Una sottospecie – spostamento, ad esempio, rame, ferro da una soluzione di solfato di rame: CuSO 4 + Fe = FeSO 4 + Cu. Poiché le particelle "di attacco" possono agire atomi, ioni o gruppi funzionali
sostituzione omolitica (radicale, SR)
Quando il meccanismo di accoppiamento covalente rottura elettroni radicale è comune ai diversi elementi saranno proporzionalmente distribuito tra i "frammenti" della molecola. La formazione di radicali liberi. Questa stabilizzazione delle particelle instabili che si verifica a seguito di reazioni successive. Ad esempio, nella preparazione di etano dal metano produrre radicali liberi coinvolti nella reazione di sostituzione: CH 4 CH 3 • • + H; CH 3 • + • CH 3 → C2H5; H • + • H → H2. Omolitica scissione del legame sul comando di sostituzione è caratteristica di alcani, la reazione è un carattere catena. Gli atomi metano H possono essere successivamente sostituiti da cloro. Analogamente a reagire con bromo, iodio ma è in grado di sostituire direttamente alcani idrogeno, fluoro reagisce troppo energicamente con loro.
metodo di scissione del legame eterolitico
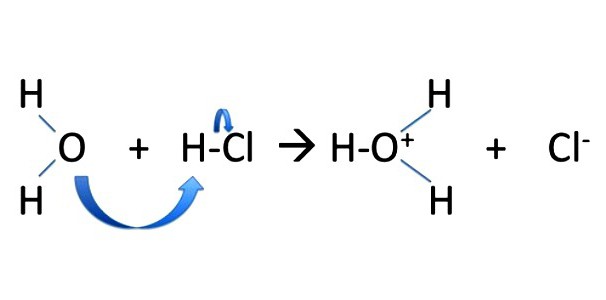
Quando il meccanismo di reazioni di sostituzione flusso di ioni, elettroni sono distribuiti equamente tra le particelle appena sorta. La coppia di elettroni di legame si estende fino ad uno dei "frammenti", il più delle volte, al partner di comunicazione, il lato che aveva compensato densità negativa nella molecola polare. Per sostituzione reazioni comprendono la reazione di formazione di alcool metilico CH 3 OH. In brommetane molecola gap CH3Br è carattere eterolitico, le particelle cariche sono stabili. Metil acquista una carica positiva, e bromo – negativo: CH 3 Br → CH 3 + + Br -; NaOH → Na + + OH -; CH 3 + + OH – → CH 3 OH; Na + + Br – ↔ NaBr.

Elettrofili e nucleofili
Le particelle che mancano gli elettroni e li può accettare, sono chiamati "elettrofili." Questi sono atomi di carbonio legati con alogeni in haloalkanes. Nucleofili hanno alta densità elettronica, sono "vittime" di una coppia di elettroni per creare un legame covalente. Le reazioni di sostituzione ricchi cariche negative vengono attaccati da nucleofili elettrofili, deficit di elettroni. Questo fenomeno è associato con il movimento degli atomi o altre particelle – gruppo uscente. Un'altra varietà di reazioni di sostituzione – attaccare il nucleofilo elettrofilo. Talvolta difficile distinguere tra i due processi, di cui la sostituzione di uno o dell'altro tipo, perché è difficile specificare esattamente che tipo di molecola – substrato e che – reagente. Di solito in questi casi, i seguenti fattori sono considerati:
- la natura del gruppo uscente;
- la reattività del nucleofilo;
- la natura del solvente;
- la porzione alchilica della struttura.
sostituzione nucleofila (SN)
Nel processo di interazione nella molecola organica è stata crescente polarizzazione. Nelle equazioni di carica parziale positiva o negativa è indicata dalla lettera dell'alfabeto greco. comunicazione Polarizzazione fornisce un'indicazione della natura della sua rottura e il futuro comportamento dei "frammenti" della molecola. Ad esempio, un atomo di carbonio in iodomethane ha una carica parziale positiva, è un centro elettrofilo. Esso attira il dipolo dell'acqua, in cui l'ossigeno ha un eccesso di elettroni. Nella reazione del elettrofilo con un nucleofilo è formato metanolo: CH 3 I + H 2 O → CH 3 OH + HI. reazioni di sostituzione nucleofila avvengono con la partecipazione di uno ione carico negativamente o molecola che ha una coppia elettrone libero, che non partecipa alla creazione di un legame chimico. La partecipazione attiva di iodometano in SN 2-reazione a causa della sua apertura alla attacco nucleofilo e la mobilità di iodio.
sostituzione elettrofila (SE)
La molecola organica può essere presente centro nucleofilo, che è caratterizzato da un eccesso di densità elettronica. Reagisce con la mancanza di cariche negative reagente elettrofilo. Tali particelle sono atomi aventi molecola orbitale connessione con porzioni di ridotta densità elettronica. Il formiato di sodio carbonio avente carica "-", viene fatto reagire con una parte positiva del dipolo acqua – idrogeno: CH 3 Na + H 2 O → CH 4 + NaOH. Il prodotto di questa reazione, sostituzione elettrofila – metano. Quando reazioni eterolitico interagisci centri di molecole organiche carica opposta, che dà loro affinità con ioni di sostanze inorganiche chimica. Non va trascurato che la conversione di composti organici è raramente accompagnata dalla formazione di questi cationi e anioni.
Unimolecolare e le reazioni bimolecolari
La sostituzione nucleofila è monomolecolare (SN1). Con questo meccanismo, un prodotto importante flussi idrolisi di sintesi organica – cloruro butilico terziario. La prima fase è lenta, è associato con progressiva dissociazione in catione carbonio ed un anione cloruro. La seconda fase è una reazione più rapida verifica di ioni carbonio e acqua. L'equazione della reazione di sostituzione di alogeno nel alcano ottenere ossidrili alcolici e primaria: (CH 3) 3 C-Cl → (CH 3) 3 C + + Cl -; (CH 3) 3 C + + H 2 O → (CH 3) 3 C-OH + H +. Per una fase di idrolisi di alogenuri alchilici primari e secondari caratterizzata dalla distruzione simultanea di carbonio a causa alogeno e la formazione di coppia C-OH. Questo meccanismo nucleofila bimolecolare sostituzione (SN2).
meccanismo di sostituzione eterolitico
meccanismo di sostituzione comporta il trasferimento di elettroni, la creazione di complessi intermedi. La reazione procede più rapidamente, più è facile per gli intermedi tipici per lei. Spesso il processo sta andando in più direzioni contemporaneamente. Il vantaggio di solito ottiene il modo in cui vengono utilizzate le particelle, che richiede il minimo dispendio di energia per la sua formazione. Ad esempio, la presenza di un doppio legame aumenta la probabilità di un catione di allile CH 2 = CH-CH 2 +, rispetto al CH3 + ione. La ragione risiede nella densità elettronica del legame multiplo, che colpisce la delocalizzazione della carica positiva, dispersi sull'intera molecola.
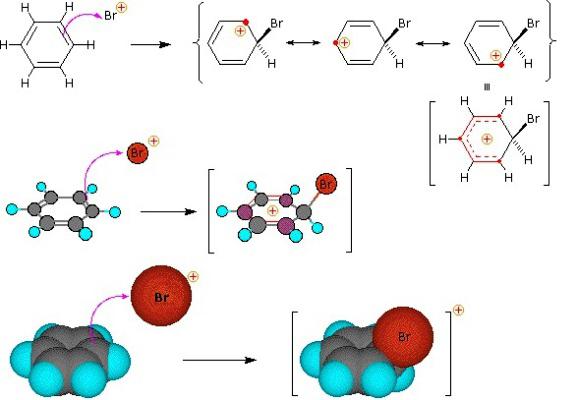
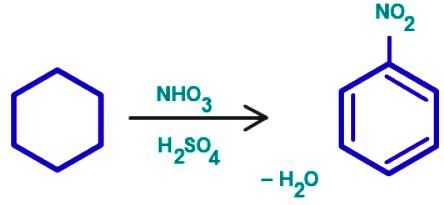
reazione di sostituzione benzene
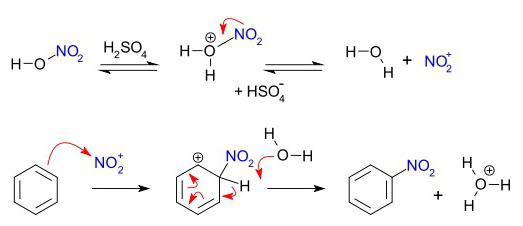
Il gruppo di composti organici, che sono caratterizzati dalla sostituzione elettrofila – scena. Anello Benzene – un oggetto comodo per attacco elettrofilo. Il processo inizia la comunicazione con il secondo reattivo di polarizzazione, formando così nuvola elettronica elettrofilo adiacente all'anello benzenico. Il risultato è una transizione complessa. Preziosi comunicazione particelle elettrofili con uno degli atomi di carbonio non ancora, è attratto all'intera carica negativa "aromatici" sei elettroni. Nella terza fase del processo elettrofilo e un atomo di carbonio dell'anello lega una comune coppia di elettroni (legame covalente). Ma in questo caso, è la distruzione della "aromatico sei", che è svantaggioso in termini di raggiungere uno stato stabile di energia sostenibile. V'è un fenomeno che può essere definito un "rilascio di un protone." Si scisso H +, il recupero di un sistema di comunicazione stabile, areni tipici. sostanza laterale comprende idrogeno catione di un anello benzenico e l'anione del secondo reagente.
Esempi di reazioni di sostituzione della chimica organica
Per alcani specialmente tipica reazione di sostituzione. Esempi di reazioni elettrofile e nucleofile possono portare a cicloalcani e areni. reazioni simili nelle molecole delle sostanze organiche sono in condizioni normali, ma solitamente – e mediante riscaldamento in presenza di catalizzatori. Da processi comuni e ben studiato includere sostituzione aromatica elettrofila. La reazione più importante di questo tipo:
- Nitrazione del benzene con acido nitrico in presenza di H 2 SO 4 – segue lo schema: C 6 H 6 → C 6 H 5 -NO 2.
- Alogenazione catalitica del benzene, specialmente clorazione, dall'equazione: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl.
- solfonazione aromatico ricavato benzene con "fumante" acido solforico, acido benzensolfonico si formano.
- Alchilazione – sostituzione dell'atomo di idrogeno dalla anello benzenico di alchile.
- Acilazione – la formazione di chetoni.
- Formilazione – sostituzione di un idrogeno su un gruppo CHO e la formazione di aldeidi.
Per sostituzione reazioni includono la reazione di alcani e cicloalcani, in cui gli alogeni attaccano disponibili legame C-H. Derivatizzazione può essere associato con la sostituzione di uno, due o tutti gli atomi di idrogeno in idrocarburi saturi e cicloparaffine. Molti di galogenoalkanov di basso peso molecolare vengono utilizzati nella produzione di sostanze più complesse appartenenti a classi diverse. I successi ottenuti nello studio dei meccanismi delle reazioni di sostituzione, ha dato un forte impulso allo sviluppo di sintesi sulla base di alcani, ciclo-stage e idrocarburi alogenati.