Acido arsenico: composizione formula chimica. sostanza altamente pericolosa
Effetti di diverse sostanze chimiche sul corpo umano è ambiguo. composti maggior parte di noi conosce o sono neutrali, e svolgere un ruolo positivo nella vita umana. Ma c'è un gruppo di sostanze, che rappresenta una grave minaccia per la salute. Essi sono suddivisi in diverse classi. Considerato in questo acido arsenico articolo – una di queste sostanze chimiche tossiche. Secondo la classificazione attualmente accettato, è incluso nella seconda classe di alto rischio, insieme con composti cloroformio, piombo e litio. Studiamo le proprietà di arsenico acido maggiore dettaglio.
struttura molecolare e lo stato fisico della materia
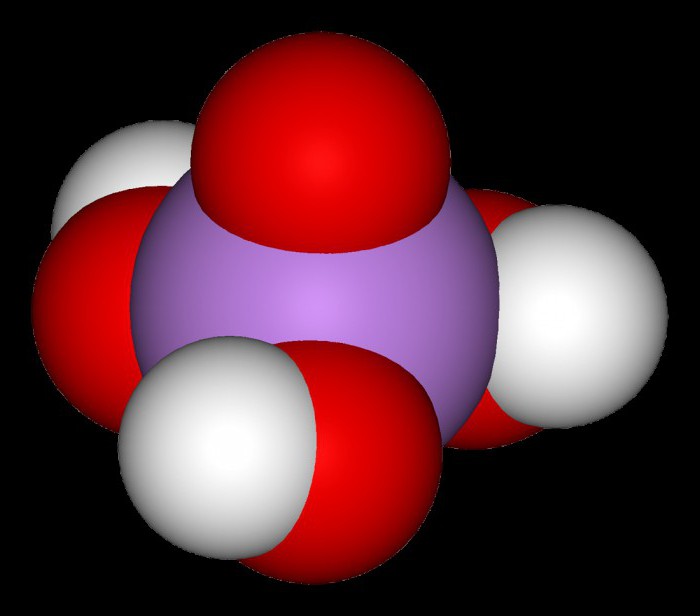
Questo composto in condizioni normali ha una struttura cristallina. Essendo un tribasico, acido arsenico, in cui formula H 3 AsO 4 ha sia secondarie e sali acidi. Ad esempio, gidroarsenat potassio – K 2 Haso 4, digidroarsenat sodio – NaH 2 AsO 4, litio arseniato – Li 3 AsO 4. acido arsenico calcinazione, arsenico ottenuto gemipentoksid chiamati arsenico pentossido. I suoi cristalli bianchi trasparenti formano una massa vetrosa, è scarsamente solubile in acqua.
dissociazione
H3AsO 4, insieme con acido formico e idrossido di piombo è moderatamente elettrolita debole. Pertanto, nella tabella acido principali acidi ionizzazione ortomyshyakovaya ha tre costanti di dissociazione: 5.6 x 10 -3, 1,5 x 10 -7 e 3, 89 x 10 -12. Questi indicatori caratterizzano quantitativamente la forza acida. In conformità con costanti di dissociazione in un numero di acidi inorganici H 3 AsO 4 occupa una posizione tra il cromo e acidi antimonio. chimici russi sperimentatori AL e I. L. Agafonovy formulati espressione matematica, in cui il rapporto derivata prima e seconda costante di dissociazione dell'acido arsenico da una temperatura che varia da 0 ° C a 50 ° C.
Soprattutto le proprietà chimiche
Il grado di ossidazione di atomi di arsenico costituenti la molecola di acido, è 5. Si riferisce al fatto che il composto stesso in reazioni chimiche con altre sostanze presenta proprietà ossidanti. Così, durante la sua interazione con l'ioduro di potassio agisce come agente riducente, in un mezzo acido troviamo arsenioso è H 3 AsO 3 tra i prodotti di reazione. Ricordiamo che l'acido arsenico, in cui formula H 3 AsO 4 è tribasico, e quindi, reazioni con basi alcalini o insolubile, può dare tre tipi di sali: medio, idro e digidroarsenaty. reazione qualitativo AsO 4 3- ioni nella chimica analitica dell'interazione stessa è acido arsenico e suoi sali con sali d'argento solubili, come il nitrato. Come risultato dell'osservazione precipitazione Ag 3 AsO 4 colore del caffè.
metodo iodometrico per la determinazione dell'acido arsenico
In chimica analitica, un compito importante è rilevare composti chimici nelle soluzioni. Arsenico acido, proprietà chimiche che abbiamo discusso in precedenza, possono essere rilevati micrometodo iodometria. A 1 ml della sua soluzione è versata lo stesso volume di 4N. acido cloridrico e 1 ml di una soluzione al 4% di ioduro di potassio. Formata sesquioxide arsenico As 2 O 3, la cui massa sotto quantità quantitative rigorose di reagenti è sempre la stessa ed è pari a 0,5746 mg.

La capacità ossidante di acido arsenico
Come è noto, H 3 AsO 4 come acido ortofosforico, una forza media elettrolita. I suoi cristalli bianchi trasparenti sono deliquescenti e sono formulati 2H 3 AsO 4 x H 2 O. I suoi sali formati con metalli alcalini (come media, e l'acido), in soluzioni acquose hanno un pH superiore a 7. arseniati litio, potassio, sodio e ammonio facilmente solubile in acqua, e il resto del sale Medio non si dissolve in esso. L'acido arsenico – un buon ossidante. In reazioni redox, viene ripristinato l'acido arsenous o arsina.
H 3 AsO 4 + 2e + 2H + = H 3 AsO 3 + H 2 O
H 3 AsO 4 + 8e + 8H + = AsH 3 + 4H 2 O
Inoltre, l'acido arsenico ossida facilmente vari metalli, ioduro solfito e acido, e solfuro di idrogeno.

Preparazione di acido arsenico
In condizioni di laboratorio, H 3 AsO 4 può essere ottenuta facendo reagire sesquioxide arsenico con acido nitrico sotto riscaldamento. I prodotti rilevati ossido nitroso e H 3 AsO 4. Un altro metodo di preparazione – è la dissoluzione in acqua di ossido di arsenico. Frequentemente utilizzati per ottenerla simultaneamente ossidazione e idrolisi trialkilarsenitov riscaldata a 50 ° C con una soluzione di perossido di idrogeno. Contemporaneamente, la miscela di reazione viene rimosso da acqua e alcol. La soluzione è stata quindi evaporata e l'acido arsenico elevata purezza ottenuta. In natura, la materia prima per l'acido arsenico sono minerali arsenolite e arsenopyrite, che sono ricchi di giacimenti di Chelyabinsk e Chita Regione della Federazione Russa.
H3AsO4 Application
Dato che ortomyshyakovaya acido è uno dei veleni più forti. La sua applicazione nell'industria e nella vita quotidiana è limitata. Più comune sale – arseniati, la cui tossicità è molto inferiore a quella della maggior H 3 AsO 4. Pertanto, nel settore della lavorazione del legno con solfato di zinco e sale di sodio pentaclorofenolo, acido arsenico è usato per il trattamento del legno. Questo metodo riduce al minimo la perdita dalla distruzione delle infezioni fungine di cellulosa e larve di coleotteri, tarli del legno. In medicina H 3 AsO 4 viene utilizzato nella preparazione "Atoxil" per il trattamento delle infezioni da protozoi, come giardiasi, Balantidiasis, isosporiasi.

Va notato che la popolazione infetta queste infezioni negli ultimi anni è aumentato drammaticamente. Ci sono diversi motivi – per esempio, l'infezione da alimenti contenenti spore protozoi, di punture di insetti o sessualmente. acido arsenico è usato come materiale di partenza nel processo di produzione di vetri ottici, così come in ingegneria elettrica. H derivato 3 AsO 4 – il suo sale sodico, viene applicata con successo in dermatologia e tubercolosi. Composti usati nella arsenico dentale (pasta arsenico) come farmaco usato per abbassare la sensibilità al dolore del nervo infiammato alla rimozione da un canale dente.
L'azione dell'acido sul corpo umano
Come accennato in precedenza, H 3 AsO 4 incluso nella seconda classe rischio accresciuto – sostanze altamente pericolose. Considerato dose letale sia l'acido e suoi sali nella gamma da 15 a 150 mg per chilogrammo di corpo umano. Insieme con effetto tossico comune, acido arsenico provoca necrosi della pelle e delle mucose degli organi interni: polmoni, stomaco, intestino.
In laboratorio, negli esperimenti con arseniato e H 3 AsO 4 è richiesto di utilizzare guanti protettivi e stessi esperimenti sono stati eseguiti in una cappa aspirante. Nel caso del livello di tossicità cellulare violata suo sistema enzimatico di inattivazione degli enzimi. Negli esseri umani, l'avvelenamento arsenato porta alla paresi o addirittura paralisi. In oncologia la chemioterapia con il mancato rispetto regimi di dosaggio di farmaci e casi di avvelenamento miarsenolom novarsenolom registrato. Primo soccorso per avvelenamento sali dell'acido arsenico è immediata lavanda gastrica (ad esempio unitiola sodio o biossido di silicio preparati).

Per prevenire l'insufficienza renale acuta, l'emodialisi è prescritto. Come antidoto inoltre unitiola soluzione al 5%, è possibile utilizzare fitoprotettore Strizhevskaya. Prima dell'arrivo dei primi aiuti di emergenza a casa per ridurre il livello di intossicazione può essere utilizzata una soluzione di acido citrico, poi provocare il vomito e lavare lo stomaco. Tutte le misure terapeutiche devono essere eseguite in conformità ai rigorosi riposo a letto sotto controllo medico.










