Il calore di formazione – che cosa è questo?
Si parla di quello che è il calore di formazione, nonché definire le condizioni che hanno standard. Al fine di risolvere questo problema, scoprire le differenze tra le sostanze semplici e complessi. Per consolidare il concetto di "calore di formazione", si consideri l'equazione chimica specifica.

L'entalpia standard di formazione di sostanze
76 kJ di energia liberata nella reazione di carbonio con l'interazione gas idrogeno. In questo caso, la cifra – è l'effetto termico della reazione chimica. Ma questo calore di formazione di molecole di metano da sostanze semplici. "Perché?" – Si chiede. Ciò è dovuto al fatto che i componenti di partenza sono carbonio e idrogeno. 76 kJ / mol è l'energia che i chimici chiamati "calore di formazione".
Schede
In termochimica esistono numerose tabelle, che contengono il calore di formazione di varie sostanze chimiche da sostanze semplici. Ad esempio, il calore di formazione della sostanza, la cui formula CO 2 allo stato gassoso ha una cifra di 393,5 kJ / mol.
importanza pratica
Perché i valori dei dati? Il calore di formazione – un valore, che viene utilizzato durante il calcolo dell'effetto termico di qualsiasi processo chimico. Al fine di condurre tali calcoli richiedono l'uso della legge di termochimica.

termochimica
Si tratta di una legge fondamentale che spiega i processi energetici osservati nel corso della reazione chimica. Durante l'interazione osservati cambiamenti qualitativi nel sistema reagente. Alcune sostanze scompaiono, nuovi componenti appaiono al loro posto. Questo processo è accompagnato da una variazione dell'energia interna del sistema, è mostrato in forma di lavoro o di calore. L'opera, che è associato con l'estensione, per le reazioni chimiche è la cifra più bassa. Il calore liberato nella conversione di un componente in un'altra sostanza può essere un grande valore.
Se consideriamo una serie di trasformazioni, quasi tutto quello che c'è assorbimento o rilascio di una certa quantità di calore. termochimica – una sezione speciale è stato creato per una spiegazione dei fenomeni.
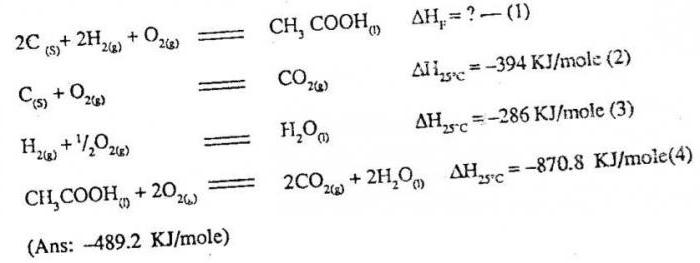
La legge di Hess
A causa della prima legge della termodinamica, è stato possibile effettuare il calcolo dell'effetto termico a seconda delle condizioni della reazione chimica. calcoli basati sulla legge termochimica principale, vale a dire la legge di Hess. Let sua formulazione: termico trasformazione effetto chimico legato alla natura, lo stato iniziale e finale del materiale, non è associato al percorso di interazione.
Quello che segue da questa formulazione? Nel caso di un prodotto specifico non deve essere applicata solo una forma di interazione, la reazione può essere eseguita in vari modi. In ogni caso, non importa quanto si dà il materiale desiderato, l'effetto termico del processo rimarrà valore invariato. Per definire è necessario riassumere gli effetti termici delle trasformazioni intermedie. A causa della legge di Hess è diventato possibile effettuare calcoli degli importi di effetti termici, non è possibile effettuare nel calorimetro. Ad esempio, per quantificare il calore di formazione di sostanze di monossido di carbonio calcolati dalla legge di Hess, ma per la sperimentazione di routine per determinare che non avrà successo. È quindi importante tavoli termochimici speciali in cui i valori numerici elencati per varie sostanze definite in condizioni standard
Punti importanti nel calcolo
Dato che il calore di formazione – è il calore di reazione, di particolare importanza è lo stato di aggregazione della sostanza in questione. Ad esempio, quando le misurazioni assumono è considerato uno stato normale di grafite, invece di diamante. tener conto anche della pressione e della temperatura, cioè, le condizioni in cui è inizialmente reagire componenti. Queste grandezze fisiche sono in grado di esercitare un'influenza significativa sulla reazione, viene aumentata o ridotta quantità di energia. Al fine di eseguire calcoli di base in termochimica deciso di utilizzare indicatori concreti di pressione e temperatura.
condizioni standard
Perché il calore di formazione della materia – la determinazione degli effetti dell'energia è in condizioni standard, distinguerli singolarmente. Temperatura prescelta per il calcolo di 298K (25 gradi centigradi) Pressione – 1 atmosfera. Inoltre, un punto importante, che vale la pena prestare attenzione è il fatto che il calore di formazione di sostanze semplici è zero. Questo è logico, perché le sostanze semplici non formano essi stessi, cioè, non c'è consumo di energia per la loro presenza.
Elementi di termochimica
Questa sezione della chimica moderna ha un significato speciale, perché è qui effettuato calcoli importanti sono risultati utilizzati nella produzione di energia termica. In termochimica, ci sono molti termini e concetti che sono importanti per operare per ottenere i risultati desiderati. L'entalpia (? H) indica che una reazione chimica ha avuto luogo in un sistema chiuso, non v'è stato alcun effetto sulla risposta dagli altri reagenti, la pressione era costante. Questo chiarimento consente di parlare circa l'accuratezza dei calcoli effettuati.
A seconda di quello che è considerato tipo di reazione, la grandezza e il segno dell'effetto termico risultante può variare in modo significativo. Quindi, per tutte le conversioni attinenti decomposizione di sostanze complesse in diversi componenti semplici, si presume assorbimento di calore. Collegamento di una pluralità di materiali di reazione di partenza in un prodotto più complesso accompagnata dal rilascio di notevoli quantità di energia.

conclusione
Nel risolvere qualsiasi problema di termochimica applicare lo stesso algoritmo di azioni. In primo luogo, nella tabella viene determinato per ciascun componente di partenza, così come prodotti di reazione quantità di calore di formazione, senza dimenticare lo stato di aggregazione. Successivamente, la legge armata Hess equivale a determinare le incognite.
Particolare attenzione deve essere rivolta al conto fattori stereochimica esistenti prima che la sostanza iniziale o finale di una particolare equazione. Se la reazione è sostanze semplici, il loro calore standard di formazione è uguale a zero, cioè, tali componenti non hanno alcun effetto sul risultato ottenuto dai calcoli. Provare a utilizzare le informazioni su una specifica reazione. Se prendiamo come esempio il processo di formazione di ossido di ferro (Fe 3+) metallo puro facendo reagire con la grafite, il valore di riferimento può essere trovato calori standard di formazione. Per l'ossido di ferro (Fe 3+) sarà -822,1 kJ / mol per la grafite (sostanza semplice) è zero. La reazione risultante produce monossido di carbonio (CO), per cui l'indicatore ha un valore di – 110,5 kJ / mol, mentre il calore di formazione rilasciato ferro corrisponde a zero. Registrazione calori standard di formazione di questa interazione chimica è caratterizzato come segue:
Circa 298 H = 3 × (-110,5) -? (-822,1) = -331,5 + 822,1 = 490,6 kJ.
Analyzing ottenuto dalla legge Hess risultato numerico, è possibile effettuare una logica conclusione che il processo è una conversione endotermica, cioè esso assume zatrachivaniya reazione di riduzione ferro energia del suo ossido ferrico.