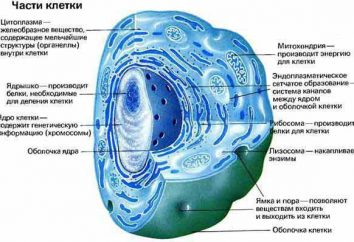
Massa atomica relativa è stata calcolata sforzi di molti scienziati
Ogni sostanza non è qualcosa di solido, si compone di piccole particelle che costituiscono la molecola. Molecole di atomi. Da ciò si può concludere che determina la massa di una sostanza in grado di caratterizzare molecole e atomi inclusi elementi. Un tempo, la maggior parte delle opere di Lomonosov splendeva questo argomento. Tuttavia, molti naturalisti curiosi sempre interessati alla domanda: "In che unità è espressa dalla massa molecolare, la massa di un atomo?"
Ma prima, un po 'di scavare nella storia 
In passato per unità di massa è sempre preso peso di atomi di idrogeno (H). E, su questa base, abbiamo fatto tutti i calcoli necessari. Tuttavia, la maggior parte dei composti presenti in natura sotto forma di composti ossigenati, tuttavia elemento massa calcolata atomo rispetto al ossigeno (O). Che è piuttosto scomodo, così hanno dovuto essere presi in considerazione nel calcolo del rapporto costante A: N di 16: 1. Inoltre, studi hanno dimostrato un'imprecisione nel rapporto, in realtà è uguale a 15.88: 1 e 16: 1.008. Tali cambiamenti dovuti agli atomi di convertire la massa a molti elementi. E 'stato deciso di lasciare circa 16 valore di peso, e per H – 1008. Ulteriore sviluppo della scienza ha portato alla divulgazione della natura del ossigeno. Si è trovato che la molecola di ossigeno ha diversi isotopi con masse 18, 16, 17. Per la fisica non è accettabile utilizzare unità aventi un valore medio. Così, si sono formate le due scale dei pesi atomici: in chimica e fisica. Solo nel 1961, gli scienziati hanno concluso che è necessario creare una singola scala, che viene utilizzato nel nostro giorno sotto il nome di "unità di carbonio." Come risultato, il relativo peso atomico dell'elemento rappresenta un atomo di carbonio in unità di peso.
I metodi di calcolo 
molecola di massa consiste di qualsiasi massa sostanza di atomi che costituiscono questa molecola. Concludiamo che la massa della molecola da esprimere in unità di carbonio, come pure la massa dell'atomo, cioè, massa atomica relativa è determinata in base alla relativa massa molecolare. Come è noto, usando la legge di Avogadro in grado di determinare il numero di atomi nella molecola. Conoscendo il numero di atomi e molecole della massa, possiamo calcolare la massa atomica. Ci sono diversi modi per definirla. Nel 1858 godu Cannizzaro proposto un metodo con cui il peso atomico relativo determinato quegli elementi che sono in grado di formare un composto gassoso. Tuttavia, questo non ha la capacità di metalli. Pertanto, il metodo è stato scelto per la determinazione delle loro masse atomiche, utilizzando dipendenza massa atomica e la capacità termica della sostanza. Ma tutti i metodi di cui sopra solo dare valori indicativi di masse atomiche.
 Come è stato calcolato massa esatta di atomi di un elemento?
Come è stato calcolato massa esatta di atomi di un elemento?
Come dimostrato da studi scientifici di questi valori approssimativi può essere determinato accurate. Per fare questo, solo il valore che si desidera confrontare con l'equivalente. elemento equivalente pari al rapporto dell'elemento massa atomica rispetto alla sua valenza composto. Questo rapporto è stato determinato corretta massa atomica relativa di ciascun elemento.