L'enzima catalasi: caratteristiche principali
Catalasi – un enzima presente in quasi tutti gli organismi viventi. La sua funzione principale – per catalizzare la decomposizione del perossido di idrogeno in sostanze innocue per l'organismo. Catalasi è di grande importanza per la vita delle cellule, come li protegge dalla distruzione da specie reattive dell'ossigeno.
Panoramica
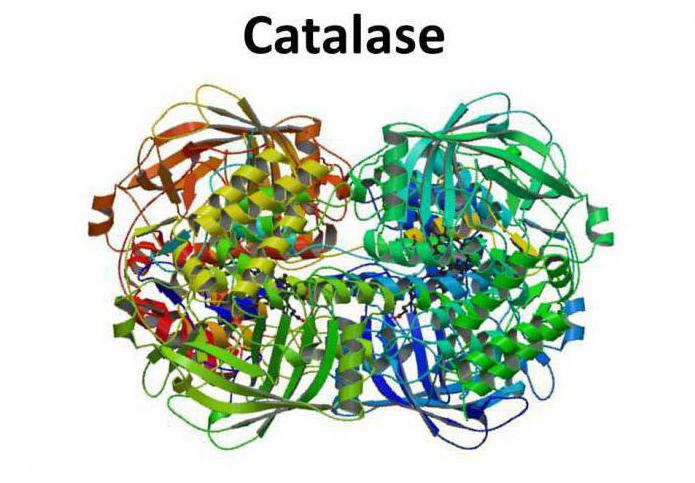
L'enzima catalasi riferisce ad ossidoriduttasi – ampia classe di enzimi che catalizzano il trasferimento di elettroni dalla molecola riducente (donatore) alla molecola ossidante (accettore).
Il pH ottimale per catalasi nel corpo umano è di circa 7, tuttavia, la velocità di reazione non varia significativamente a valori dell'indice di idrogeno da 6.8 a 7,5. Il pH ottimale per altri catalasi variano da 4 a 11, a seconda del tipo di microrganismo. La temperatura ottimale è inoltre differente per una persona è di circa 37 ° C
Catalasi – uno degli enzimi più veloci. Una sola molecola è in grado di convertire i suoi milioni di molecole di perossido di idrogeno in acqua e ossigeno al secondo. In termini di enzimologia che significa che un gran numero di giri caratteristici dell'enzima catalasi.
struttura enzima
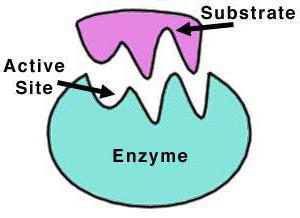
Catalasi è un tetramero di quattro catene polipeptidiche, ciascuna delle quali ha più di 500 amminoacidi in lunghezza. L'enzima è composto da quattro gruppi di eme porfido, e attraverso il quale reagisce con ossigeno attivo. Il gruppo eme prostetico ossidato è un catalasi.
La storia della scoperta
Catalasi non era noto agli scienziati 1818 anni fino a quando Louis Jacques Thénard chimico scoperto in cellule di perossido di idrogeno vivente non è suggerito che la sua distruzione a causa dell'azione di un materiale biologico sconosciuto.

Nel 1900, un chimico tedesco, Oskar Leo introdotto il termine "catalasi" per riferirsi ad una sostanza in decomposizione di perossido di misterioso. Era in grado di rispondere alla domanda, in cui l'enzima catalasi contenuta. Come risultato di numerosi esperimenti Oskar Leo rivelato che questo enzima è caratteristica di quasi tutti gli animali e piante. Nelle cellule viventi, così come molti altri enzimi, catalasi è contenuto in perossisomi.
Nel 1937 è stato il primo a cristallizzare catalasi da fegato di manzo. 250 kD – peso molecolare dell'enzima è stata determinata nel 1938. Nel 1981 gli scienziati hanno ricevuto le immagini della struttura tridimensionale di bovini catalasi.
La catalisi di perossido di idrogeno
Nonostante il fatto che il perossido di idrogeno – un prodotto di molti processi metabolici normali, non è innocuo per il corpo.
 Per impedire la distruzione di cellule e tessuti, perossido di idrogeno deve essere rapidamente convertita in altre, meno pericoloso per il corpo. È a questo problema e affronta enzima catalasi – si decompone il perossido di due molecole di molecole d'acqua e molecole di ossigeno.
Per impedire la distruzione di cellule e tessuti, perossido di idrogeno deve essere rapidamente convertita in altre, meno pericoloso per il corpo. È a questo problema e affronta enzima catalasi – si decompone il perossido di due molecole di molecole d'acqua e molecole di ossigeno.
La reazione di decomposizione del perossido di idrogeno in tessuti viventi:
2 H 2 O 2 → 2 H 2 O + O 2
Il meccanismo molecolare dell'enzima scissione del perossido di idrogeno mediante catalasi non è ancora esattamente compreso. Si presume che la reazione avviene in due fasi – il primo stadio costituito da ferro catalasi gruppo prostetico legato ad un atomo di ossigeno del perossido, questo genera una molecola di acqua. Nella seconda fase l'eme ossidato interazione con un'altra molecola di perossido di idrogeno, formando così un'altra molecola di acqua e una molecola di ossigeno.
Attraverso questa azione dell'enzima catalasi per il perossido di idrogeno, la presenza del principio attivo nei campioni di tessuto viene facilmente determinata. Per questo aggiungere sufficiente alla prova assaggiare una piccola quantità di perossido di idrogeno e osservare la reazione. La presenza dell'enzima indica la formazione di bolle di ossigeno. Questa reazione è buono perché non richiede strumenti o attrezzature speciali – può essere visto ad occhio nudo.

Vale la pena notare che uno ione di un metallo pesante può agire come un inibitore non competitivo di catalasi. Inoltre, tutti cianuro nota si comporta come un inibitore competitivo di catalasi, se in molti tessuti del perossido di idrogeno. Arsenati agiscono come attivatori.
applicazione
Azione dell'enzima catalasi decompone il perossido di idrogeno è stato utilizzato nell'industria alimentare – utilizza questo enzima viene rimosso dal latte H 2 O 2 alla preparazione del formaggio. Un'altra applicazione – confezione speciale alimento che protegge il prodotto contro l'ossidazione. Catalasi viene utilizzato anche nell'industria tessile per la rimozione di acqua ossigenata da tessuti.
Viene utilizzato nell'igiene di lenti a contatto in piccole quantità. Alcuni disinfettanti sono composti di perossido di idrogeno e catalasi viene utilizzato per dividere questo componente prima di riutilizzare lenti.
attività
Attività di catalasi enzima dipende dall'età dell'organismo. I giovani tessuti del attività enzimatica è molto più alta rispetto al vecchio. Con l'età nell'uomo e negli animali catalasi gradualmente diminuisce a causa dell'invecchiamento dei tessuti e organi.
Secondo un recente studio, una diminuzione di attività della catalasi è una delle possibili cause di incanutimento dei capelli. Il perossido di idrogeno è prodotto continuamente nel corpo umano, ma nessun danno – catalasi si decompone rapidamente. Ma se il livello di questo enzima è ridotta, è ovvio che non tutto il perossido di idrogeno è catalizzata dall'enzima. Così, scolorisce dall'interno del capello sciogliendo tinture naturali. Questa scoperta inaspettata attualmente in fase di test da parte dei ricercatori, e può giocare un ruolo nello sviluppo di farmaci, sospendendo incanutimento dei capelli.