composti dell'azoto. Proprietà di azoto
Dando vita a nitrati – come tradotto dal latino Nitrogenium. Questo azoto titolo – elemento chimico con un numero atomico 7, testa 15 ° gruppo nella versione lunga della tavola periodica. Sotto forma di un semplice sostanza composta di terra distribuiti air bag – atmosfera. Una varietà di composti azotati trovato nella crosta terrestre, e gli organismi viventi sono ampiamente usati nelle industrie, militari, l'agricoltura e la medicina.
Perché l'azoto chiama "soffocamento" e "senza vita"
Come gli storici della chimica suggeriscono prima ottenuto questa semplice sostanza Henry Cavendish (1777). Scientific passa l'aria sui carboni ardenti per l'assorbimento dei prodotti di reazione con alcali. Come risultato dell'esperienza ricercatore trovato gas incolore e inodore, carbone non reagito. Cavendish ha definito "l'aria soffocante" per l'incapacità di mantenere la respirazione e la combustione.
Chimica moderna spiegato che l'ossigeno viene fatto reagire con carbone, si forma anidride carbonica. Il restante "soffocamento" dell'aria era per la maggior parte delle molecole N 2. Cavendish e gli altri scienziati del tempo su questo argomento non è ancora noto, anche se composti di azoto e nitrati poi sono stati ampiamente utilizzati per l'economia. Lo scienziato ha parlato del gas insolito per un collega per condurre esperimenti simili – Joseph Priestley.
Allo stesso tempo, Carl Scheele ha attirato l'attenzione alla componente sconosciuta dell'aria, ma non è riuscito a spiegare adeguatamente la sua origine. Solo Daniel Rutherford nel 1772 si rese conto che le attuali esperimenti "soffocante" "viziati" gas – azoto. Alcuni scienziati ritengono il suo scopritore – è ancora dibattito storici della scienza.

15 anni dopo gli esperimenti di Rutherford famoso chimico Antuan Lavuaze ha proposto di sostituire l'aria termine "rovinato" si riferisce ad azoto, dall'altro – Nitrogenium. Con il tempo è stato dimostrato che questa sostanza non brucia, non supporta la respirazione. Poi c'erano il nome russo "di azoto", che viene interpretato in modi diversi. Spesso dire che il termine significa "senza vita". Studi successivi hanno confutato la convinzione diffusa sulle proprietà delle sostanze. composti azotati – proteine – le grandi macromolecole nella composizione degli organismi viventi. Per costruire piante assorbono dagli elementi necessari suolo nutrizione minerale – 2- ioni NO 3 e NH 4 +.
L'azoto – un elemento chimico
Per comprendere la struttura e le proprietà atomica aiuta il sistema periodico (PS). La posizione dell'elemento chimico della tavola periodica può definire carica nucleare, numero di protoni e neutroni (numero di massa). E 'necessario prestare attenzione al valore della massa atomica – questa è una delle principali caratteristiche dell'elemento. periodo, il numero corrisponde al numero di livelli energetici. La versione corta del numero tavola periodica Gruppo corrisponde al numero di elettroni nel livello energaticheskom esterno. Riassumendo i dati delle caratteristiche generali di azoto dalla sua posizione nel sistema periodico:
- Questo è un elemento non metallico è nell'angolo superiore destro della SS.
- Simbolo chimico: N.
- Codice Proprietà: 7.
- Massa atomica relativa: 14,0067.
- Formula composti di idrogeno volatili: NH 3 (ammoniaca).
- Forma un ossido superiore N 2 O 5, che è uguale alla valenza di V. azoto
Struttura atomo di azoto:
- carica nucleare +7.
- Il numero di protoni: 7; il numero di neutroni: 7.
- Numero di livelli di energia: 2.
- Il numero totale di elettroni: 7; e formula: 1s 2 2s 2 2p 3.
Dettagli studiato isotopi stabili № elemento 7, i loro numeri di massa – 14 e 15. Il contenuto di un'atomi leggeri dei quali è 99.64%. La nuclei di isotopo radioattivo di breve durata è anche 7 protoni, e il numero di neutroni varia: 4, 5, 6, 9, 10.
L'azoto in natura
Nell'ambito delle molecole d'aria sono presenti guaina terra sostanza semplice, la cui formula – N 2. Il contenuto di azoto nell'atmosfera è circa 78,1% in volume. Composti inorganici del elemento chimico nella crosta terrestre – vari sali di ammonio e nitrati (niter). I composti della formula ei nomi di alcune delle sostanze più importanti:
- NH 3, ammoniaca.
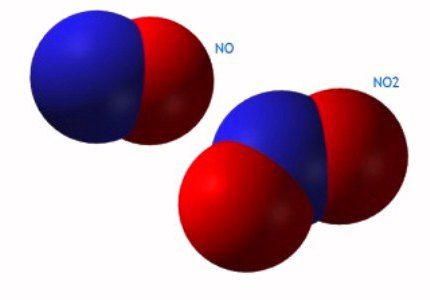
- NO biossido 2, azoto.
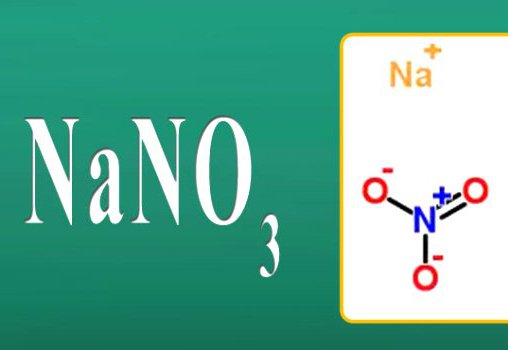
- Nano 3 Nitrato di sodio.
- (NH 4) 2 SO 4, solfato di ammonio.
La valenza dell'azoto negli ultimi due composti – IV. organismi carbone, suolo, vivente contengono anche N atomi nella forma legata. L'azoto è un componente di aminoacidi macromolecole, il DNA e nucleotidi di RNA, ormoni e di emoglobina. Il contenuto totale dell'elemento chimico nel corpo umano raggiunge 2,5%.
sostanza semplice
Azoto sotto forma di molecole biatomiche – il maggior volume e peso dell'aria nell'atmosfera. Sostanza, la cui formula è N 2, non ha odore, colore e sapore. Questo gas è più di 2/3 guaina terra aria. L'azoto liquido è una sostanza incolore, acqua simile. Bolle ad una temperatura di -195,8 ° C M (N 2) = 28 g / mol. Semplice bit sostanza facile ossigeno, azoto, aria, la sua densità è vicino a 1.
Gli atomi nella molecola legano saldamente 3 coppie di elettroni condivisi. Il composto presenta una elevata resistenza chimica, che lo distingue da ossigeno e altre sostanze gassose. Ad una molecola di azoto è suddiviso nei suoi atomi costituenti necessarie per consumare energia 942,9 kJ / mol. Contatto delle tre coppie di elettroni è molto forte, comincia ad abbattere quando riscaldata oltre 2000 ° C.
praticamente non si verifica in condizioni normali, la dissociazione delle molecole in atomi. inerzia chimica è causato anche da azoto totale assenza di polarità nella sua molecola. Interagiscono molto debolmente con l'altro, cooperando a tal stato gassoso della materia a pressione normale e ad una temperatura prossima alla temperatura ambiente. Bassa attività chimica di azoto molecolare è utilizzata in diversi processi e dispositivi in cui è necessario creare un ambiente inerte.
Dissociazione di molecole N 2 può verificarsi sotto l'influenza della radiazione solare nell'atmosfera superiore. azoto atomico è formato, che reagisce con alcuni metalli e non metalli in condizioni normali (fosforo, zolfo, arsenico). Il risultato è la sintesi delle condizioni del terreno sostanze essendo ottenute indirettamente.

valenza azoto
Il guscio elettronico esterno dell'atomo formare un elettrone 2 s 3 e p. Questi azoto negativo può dare particelle quando interagiscono con altri elementi che corrispondono alle sue proprietà riducenti. Adiacente l'ottetto mancanti a 3 atomi di elettroni esibisce capacità ossidativa. Elettronegatività azoto sotto le sue proprietà metalliche sono meno pronunciata rispetto a quella di fluoro, ossigeno e cloro. Quando interagiscono con questi elementi chimici azoto dà elettroni (ossidare). Riduzione di ioni negativi seguita da reazione con altri metalli e non metalli.
Tipico di azoto valenza – III. In questo caso, i legami chimici sono formate dalla esterno p-attrazione di elettroni e la creazione di comune accoppiamento (binding). L'azoto è capace di formare legame donatore-accettore per la sua coppia di elettroni, come è il ione ammonio NH 4 +.
Ottenere in laboratorio e industria
metodi ad un laboratorio basati sulle proprietà ossidative di ossido di rame. Utilizzare composto azotato con idrogeno – ammoniaca NH 3. Questo sgradevole profumati vzaimoddeystvuet gas con polvere nera ossido di rame. La reazione risultante produce azoto e appare rame metallico (polvere rossa). Depositato sulle pareti del tubo waterdrops – altro prodotto di reazione.
Un altro metodo di laboratorio che utilizza un composto di azoto metalli – azide, ad esempio NaN 3. Ottenuto da un gas che non ha bisogno di essere pulito da contaminanti.
Il laboratorio avviene la decomposizione del nitrito di ammonio azoto e acqua. Per iniziare la reazione, il riscaldamento è richiesto, allora il processo procede con sviluppo di calore (esotermica). L'azoto è contaminato con impurità, quindi è pulito e asciugato.
Preparazione dell'azoto nel settore:
- distillazione frazionata di aria liquida – un metodo, che utilizza le proprietà fisiche di azoto e ossigeno (diverso punto di ebollizione);
- reazione chimica dell'aria con un carbone caldo;
- separazione gas adsorbimento.
L'interazione con metalli e idrogeno – proprietà ossidanti
Inerzia molecole durevoli non consentono alcune sintesi diretta di composti azotati. Per attivare gli atomi necessari a forte riscaldamento o irradiazione sostanza. Azoto può reagire con litio a temperatura ambiente, con magnesio, calcio e sodio, la reazione procede solo mediante riscaldamento. Corrispondenti nitruri metallici sono formate.
L'interazione di azoto con idrogeno avviene ad alta temperatura e pressione. Anche questo processo richiede il catalizzatore. Ammoniaca ottenuto – una delle sintesi chimica più importante. Azoto, come agente ossidante, mostra nelle loro tri negativo stati di ossidazione:
- 3 (ammoniaca e altri composti azotati, idrogeno – nitruri);
- -2 (idrazina N 2 H 4);
- -1 (idrossilammina NH 2 OH).
Il nitruro di più importante – Ammoniaca – preparato in grandi quantità nel settore. Il grosso problema per lungo tempo è rimasta l'inerzia chimica dell'azoto. Le sue fonti di materie prime erano nitrato, ma le riserve di minerali ha cominciato a diminuire rapidamente con la crescita della produzione.

La grande conquista della scienza e della pratica chimica è stata la creazione di tecnica di fissazione dell'azoto ammoniacale su scala industriale. In apposite colonnine è per sintesi diretta – un processo reversibile tra azoto ottenuto dall'aria e idrogeno. Quando si creano condizioni ottimali, sposta l'equilibrio di questa reazione al lato del prodotto, utilizzando la resa catalizzatore ammoniaca è 97%.
Interazione con l'ossigeno – riducenti
Per iniziare la reazione di azoto e ossigeno, deve essere forte riscaldamento. Possiedono energia sufficiente arco elettrico e un fulmine in atmosfera. I principali composti inorganici in cui l'azoto è nei suoi stati di ossidazione positivi:
- 1 (ossidi di azoto (I) N 2 O);
- +2 (NO di monossido di azoto);
- 3 (ossidi di azoto (III) N 2 O 3, HNO 2 acido nitroso, sali nitriti stessi);
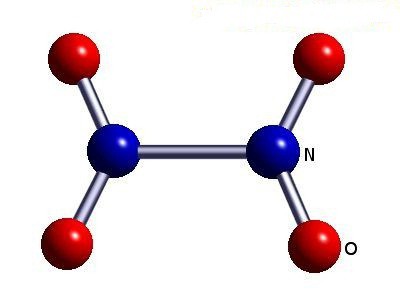
- 4 (biossido di azoto (IV) NO 2);
- 5 (pentossido di diazoto (V) N 2 O 5, acido nitrico HNO 3, nitrati).
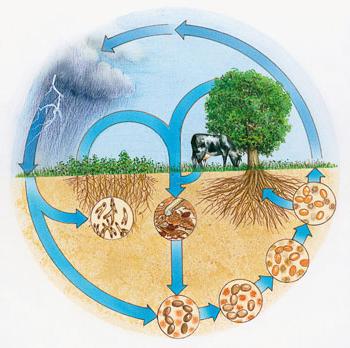
Il valore di naturale
Piante assorbono ioni ammonio e anioni nitrato dal suolo utilizzato per la sintesi di reazioni chimiche di molecole organiche nelle cellule costantemente in esecuzione. azoto atmosferico batteri nodulo può assimilare – entità microscopiche formando noduli radicali di legumi. Come risultato, questo gruppo di piante ricevuto batteria richiesto, arricchisce il terreno.
Durante tempeste tropicali verificarsi reazione di ossidazione dell'azoto atmosferico. Gli ossidi vengono sciolti a formare acidi, questi composti di azoto entrano nel terreno in acqua. A causa del ciclo degli elementi in natura sono costantemente rifornito le sue riserve nella crosta terrestre, l'aria. molecole organiche complesse contenenti azoto nella sua composizione, vengono degradati dai batteri sui componenti inorganici.
uso pratico
I principali composti azotati per agricoltura – un sale altamente solubili. Assorbita dalle piante urea nitrato (sodio, potassio, calcio), composti di ammonio (ammoniaca, cloruro, solfato, nitrato di ammonio).
Inerte proprietà azoto piante incapacità di assorbire dal conduttore esterno per la necessità di fare grandi dosi all'anno nitrati. Parti dell'organismo piante sono in grado di immagazzinare l'energia macrocell "per il futuro", che degrada la qualità del prodotto. L'eccesso di nitrati nelle verdure e frutta può causare avvelenamento negli esseri umani, la crescita di tumori maligni. Oltre all'agricoltura, composti azotati sono utilizzati in altre industrie:
- per la preparazione di medicamenti;
- per la sintesi chimica di composti ad alto peso molecolare;
- nella fabbricazione di esplosivi da tritolo (TNT);
- per la produzione di coloranti.
NO ossido trova impiego in chirurgia, la sostanza ha un effetto analgesico. Perdita di sensibilità quando il gas inalato notato che anche i primi ricercatori di azoto proprietà chimiche. Quindi c'era un nome comune "gas esilarante".
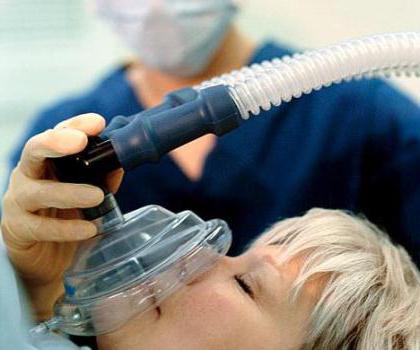
Il problema dei nitrati nei prodotti agricoli
I sali di acido nitrico – Nitrati – contenevano un anione singolarmente comportano alcun 3-. Ancora utilizzato il vecchio nome del gruppo di sostanze – nitrato di ammonio. I nitrati sono utilizzati per fertilizzare i campi, nelle serre, giardini. Portateli in primavera prima di piantare, in estate – sotto forma di poppate liquidi. Da soli, la sostanza non rappresenta un grande pericolo per le persone, ma nel corpo, vengono convertiti in nitriti, poi in nitrosammine. Nitrito NO 2- ioni – particelle tossiche, causano ossidazione del ferro ferroso nelle molecole di emoglobina nei ioni trivalenti. In questo stato, la sostanza principale del sangue umano e animale non è in grado di trasportare l'ossigeno e l'eliminazione dell'anidride carbonica dai tessuti.
La contaminazione da nitrati più pericoloso di cibo per la salute umana:
- tumori maligni che insorgono nella conversione dei nitrati di nitrosammine (cancerogene);
- lo sviluppo della colite ulcerosa,
- ipotensione o ipertensione;
- insufficienza cardiaca;
- disturbi emorragici
- lesioni del fegato, il pancreas e lo sviluppo del diabete;
- sviluppo di insufficienza renale;
- anemia, alterazioni della memoria, l'attenzione e intelligenza.
L'uso simultaneo di diversi prodotti con grandi dosi di nitrati porta ad avvelenamento acuto. Le fonti possono essere le piante, acqua potabile, piatti pronti a base di carne. Ammollo in acqua pulita e la cottura può ridurre il contenuto nutrizionale dei prodotti di nitrati. I ricercatori hanno scoperto che dosi più elevate di composti pericolosi osservate nella produzione immaturo e piante in serra.

Fosforo – elemento di gruppo dell'azoto
Atomi di elementi chimici che sono nella stessa colonna verticale del sistema periodico, presentano proprietà comuni. Fosforo si trova nel terzo periodo, si riferisce al gruppo 15, così come l'azoto. elementi di struttura atomi simili, ma ci sono differenze nelle proprietà. Azoto e fosforo presentano negativo valenza e stato di ossidazione III nei composti con metalli e idrogeno.
Molte reazioni fosforo avvenire a temperature ordinarie, un elemento chimicamente attiva. Viene fatto reagire con l'ossigeno per formare P 2 O 5 superiore ossido. La soluzione acquosa di questo materiale ha le proprietà di acido (metafosforico). Riscaldando acido ortofosforico si ottiene. Si definisce una pluralità di tipi di sali, molti dei quali sono i concimi minerali, ad esempio perfosfati. Composti di azoto e fosforo costituiscono una parte importante del ciclo di materia ed energia sul nostro pianeta, utilizzato in industriali, agricoli e altri campi.