Formula ossigeno. Tavola periodica – ossigeno
elemento chimico ossigeno memorizzato nel gruppo principale secondo periodo VI-esimo obsolete una versione breve della Tavola Periodica. Secondo i nuovi standard di numerazione – è il 16 ° gruppo. La decisione corrispondente è stata fatta da IUPAC nel 1988. Ossigeno come semplice sostanza di formula – O 2. Considerate le sue proprietà principali, ruolo in natura ed economia. Iniziamo con una descrizione di tutto il gruppo del sistema periodico, che fa capo a ossigeno. Elemento differenzia dai suoi congeneri avente la calcogeno, e l'acqua è diverso da idrogeno composti di zolfo, selenio e tellurio. La spiegazione di tutte le caratteristiche per essere trovato, solo per conoscere la struttura e le proprietà dell'atomo.
Calcogeni – elementi correlati ossigeno
immobili simili degli atomi formano un unico gruppo del sistema periodico. L'ossigeno è diretto dalla famiglia di calcogeni, ma differisce da loro in un certo numero di proprietà.
La massa atomica di ossigeno – il gruppo degli antenati – è di 16 a. .. composti E m calcogeno con formazione di idrogeno e metalli presentano loro normale stato di ossidazione -2. Ad esempio, composto da acqua (H 2 O) numero di ossidazione di ossigeno è -2.
Composizione di composti idrogeno calcogeno tipici di formula generale: H 2 acido R. La dissoluzione di queste sostanze sono formate. Solo legame idrogeno ossigeno – acqua – ha proprietà speciali. Secondo i risultati di scienziati, questa sostanza è acido inusuale e molto debole, e una base molto debole.
Zolfo, selenio e tellurio hanno tipico stato di ossidazione positivo (+4, +6) in composti con ossigeno e altri non metalli aventi elevata elettronegatività (EO). ossidi Composizione calcogeno riflettono la formula generale: RO 2, RO 3. Hanno una composizione corrispondente acido: H 2 RO 3, H 2 RO 4.
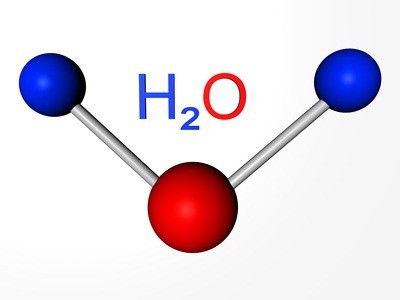
Elementi corrispondono a sostanze semplici: ossigeno, zolfo, selenio, tellurio e polonio. I primi tre membri presentano proprietà metalliche. Ossigeno Formula – Circa 2. modifica allotropica stesso elemento – ozono (O 3). Entrambe le versioni sono gas. Zolfo e selenio – non metalli solidi. Tellurio – sostanza metalloide, un conduttore di corrente elettrica, polonio – metallo.
Ossigeno – l'elemento più abbondante
Il contenuto totale di atomi dell'elemento nella crosta terrestre è di 47% (in peso). L'ossigeno si trova in forma libera, o come parte di connessioni multiple. sostanza semplice, la cui formula di O 2 è nella composizione dell'atmosfera, che costituisce il 21% di aria (in volume). ossigeno molecolare viene dissolto in acqua, è tra le particelle di terreno.
Sappiamo già che c'è un altro tipo di esistenza dello stesso elemento chimico, sotto forma di una sostanza semplice. Questo ozono – formante gas a circa 30 km dalla strato superficiale, spesso chiamato schermo ozono. ossigeno legato entra le molecole d'acqua in molte rocce e minerali, composti organici.
Struttura atomo di ossigeno
Tavola periodica contiene informazioni complete su di ossigeno:
- Il numero di serie dell'elemento – 8.
- carica nucleare – 8.
- Il numero totale di elettroni – 8.
- formula ossigeno elettronico – 1s 2s 2 2p 2 4.
In natura, ci sono tre isotopi stabili, che hanno lo stesso numero di sequenza nella Tavola Periodica, una composizione identica di protoni ed elettroni, ma diverso numero di neutroni. Isotopi sono indicati con lo stesso simbolo – O. Per tabella di confronto che mostra la composizione di tre isotopi dell'ossigeno:
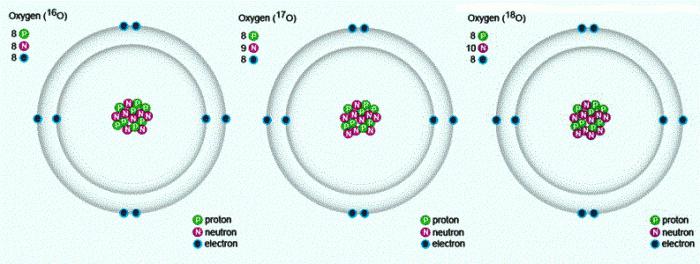
Proprietà di ossigeno – un elemento chimico
Su 2p atomo sottolivello ha due elettroni spaiati, che spiega la comparsa di ossidazione -2 e +2. Due elettroni appaiati non possono staccare, al grado di ossidazione aumentato a quattro come zolfo e altri calcogenuri. La ragione – la mancanza di sottolivello libero. Pertanto, i composti della elemento chimico non presentano valenza ossigeno e stato di ossidazione uguale numero gruppo nella versione corta del sistema periodico (6). numero medio di ossidazione è -2 per lui.
Solo con composti fluorurati esibisce ossigeno insolito stato di ossidazione +2 positivo per lui. valore di EO di due punti di forza diversi elementi non metallici EA (D) = 3.5; EE (F) = 4. Come elemento più elettronegativo, fluoro forte mantiene i suoi elettroni di valenza e attrae le particelle ad un livello di energia esterna dell'atomo di ossigeno. Pertanto, nella reazione con fluoro è ossigeno agente riducente perde elettroni.
Ossigeno – una sostanza semplice
D. inglese ricercatore Priestley nel 1774 nel corso di esperimenti identificati gas dalla decomposizione dell'ossido di mercurio. Due anni prima, la stessa sostanza nella sua forma pura era K. Scheele. Solo pochi anni dopo, il chimico francese Antoine Lavoisier ha scoperto che per il gas è una parte dell'aria, e ha studiato le proprietà. Formula chimica di ossigeno – O 2. Riflettere composizione registrazione di elettroni materia partecipare alla formazione di un legame covalente non polare – O O ::. Sostituire ogni coppia di elettroni di legame con una riga: O = O. Tale formula ossigeno mostra chiaramente che gli atomi nella molecola sono collegati da due coppie di elettroni comune.

Eseguire calcoli semplici e determinare qual è la massa molecolare relativa di ossigeno: sig (O 2) = Ar (O) x 2 = 16 x 2 = 32. Per confronto: (. Aria) Mr = 29. formula chimica di ossigeno differisce da ozono un atomo di ossigeno. Quindi, Mr (O 3) = Ar (O) x 3 = 48. L'ozono in ossigeno è 1,5 volte più pesante.
proprietà fisiche
Ossigeno – un gas senza colore, sapore e odore (a temperatura normale e pressione uguale alla pressione atmosferica). La sostanza è leggermente più pesante dell'aria; solubile in acqua, ma in piccole quantità. punto di fusione ossigeno è negativo ed è -218,3 ° C Il punto in cui l'ossigeno liquido viene riconvertito in gas – è la sua temperatura di ebollizione. Per O 2 valore molecole di questa grandezza fisica raggiunge -182,96 ° C. L'ossigeno liquido e solido diventa un colore azzurro.
Ottenere ossigeno in laboratorio
Quando riscaldato, contenente ossigeno sostanze come permanganato di potassio, è allocato un gas incolore che può essere raccolta in un pallone o tubo. Se si effettua in puro cannello ossigeno accesa, brucia più intensamente che in aria. Altri due metodo di laboratorio per la produzione di ossigeno – decomposizione del perossido di idrogeno e clorato di potassio (clorato di potassio). Si consideri il dispositivo circuitale, che viene utilizzato per la decomposizione termica.
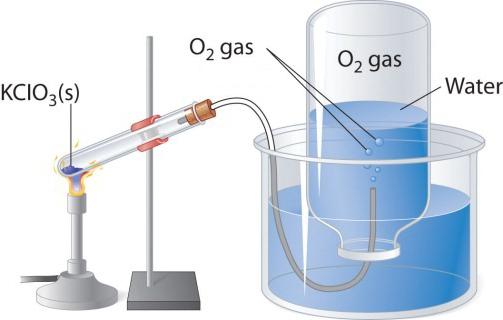
In una provetta o un pallone a fondo tondo è necessario versare un po clorato di potassio, chiudere il tappo con un tubo di uscita del gas. La sua estremità opposta deve essere inviato (subacquea) invertita capovolta nel pallone. Il collo deve essere omesso in un bicchiere o stampo riempito con acqua. Quando l'ossigeno riscaldato viene rilasciato dal sale tubo clorato. Come si entra nel tubo del vapore nel pallone, spostando acqua da esso. Quando il bulbo è riempito con gas, la sua subacqueo chiusa tappo ed invertito. Ottenuto in questo esperimento di laboratorio, l'ossigeno può essere usato per studiare le proprietà chimiche della sostanza semplice.
ardente
Se il laboratorio esegue la combustione di sostanze in ossigeno, è necessario conoscere e rispettare le norme antincendio. L'idrogeno viene bruciato istantaneamente nell'aria, mescolato con ossigeno in un rapporto di 2: 1, è esplosivo. sostanze combustione in ossigeno puro è molto più intenso in aria. Ciò si spiega con il fenomeno della composizione dell'aria. Ossigeno nell'atmosfera è poco più di 1,5 parti (21%). Combustione – una sostanza di reazione con l'ossigeno, e conseguente prodotti diversi, principalmente ossidi di metalli e non metalli. miscela ossidante di O 2 con sostanze infiammabili, in aggiunta, i composti risultanti possono essere tossici.
La combustione candela convenzionale (o partite) accompagnata dalla formazione di anidride carbonica. Il seguente esperimento può essere eseguita a casa. Se la sostanza da ardere sotto un barattolo di vetro o una tazza grande, la combustione cesserà una volta che tutto l'ossigeno viene consumato. Azoto non supporta la respirazione e la combustione. Anidride carbonica – ossidazione del prodotto – non reagisce con l'ossigeno. Trasparente calce in grado di rilevare la presenza di anidride carbonica sulla candela accesa. Se i prodotti della combustione attraversano l'idrossido di calcio, la soluzione diventa torbida. reazione chimica tra l'acqua di calce e anidride carbonica, ottenuta carbonato di calcio insolubile.

Preparazione di ossigeno su scala industriale
Il miglior processo, in cui le molecole sono ottenuti privo di aria O 2, non legato al effettuazione di reazioni chimiche. Nell'industria, ad esempio, nelle acciaierie, l'aria a bassa temperatura e alta pressione liquefatto. Tali componenti principali atmosferici come ossigeno e azoto, ebollizione a differenti temperature. Separare la miscela aria con riscaldamento graduale a temperatura ambiente. In primo luogo, molecole di azoto sono distinti, e quindi ossigeno. Il metodo di separazione basato su varie proprietà fisiche delle sostanze semplici. Formula semplice sostanza di ossigeno è la stessa come era prima il raffreddamento e la liquefazione dell'aria, – O 2.
Di conseguenza, alcune delle reazioni di elettrolisi, anche, ossigeno, viene raccolto sull'elettrodo corrispondente. fabbisogno di gas di industriali, imprese di costruzione in grandi volumi. richiesta di ossigeno è in costante crescita, in particolare ne ha bisogno l'industria chimica. Immagazzinato gas prodotto per scopi industriali e medicali in cilindri di acciaio, dotato di una marcatura. Un serbatoio di ossigeno tinto in colore blu o blu per distinguerlo da altri gas liquefatto – azoto, metano, ammoniaca.

calcoli chimici a base di formule ed equazioni di reazioni che coinvolgono O 2 molecole
Il valore numerico della massa molare di ossigeno coincide con un'altra quantità – massa molecolare relativa. Solo nel primo caso, ci sono unità. Brevemente formula sostanza ossigeno e il suo peso molecolare devono essere scritte come: M (O 2) = 32 g / mol. In condizioni normali mole di qualsiasi volume di gas corrisponde a 22,4 litri. Quindi, 1 mole di O 2 – è 22,4 litri di sostanza 2 moli O 2 – 44,8 litri. Secondo l'equazione della reazione tra idrogeno e ossigeno può essere visto che reagiscono 2 moli di idrogeno e una mole di ossigeno:
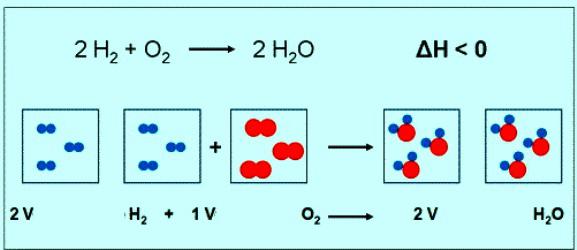
Se il gioco della reazione di 1 mole di idrogeno, la quantità di ossigeno di 0,5 moli • 22,4 l / mol = 11.2 litri.
Il ruolo di O 2 molecole in natura e della vita umana
L'ossigeno consumato da organismi viventi sulla Terra, ed è coinvolto nella circolazione di sostanze in eccesso di 3 miliardi di anni. Questa è la sostanza principale per la respirazione e il metabolismo, può scomporre le molecole nutrienti sintetizzate dal corpo ha bisogno di energia. L'ossigeno è costantemente consumato in tutto il mondo, ma le sue riserve sono ricostituiti attraverso la fotosintesi. scienziato russo K. Timiryazev ritiene che a causa di questo processo c'è ancora vita sul nostro pianeta.

Grande è il ruolo di ossigeno in natura ed economia:
- assorbita durante gli organismi viventi di respirazione;
- coinvolti nelle reazioni di fotosintesi delle piante;
- parte della molecola organica;
- processi di decadimento, fermentazione, ruggine verificano con la partecipazione di ossigeno che serve come ossidante;
- utilizzato per la sintesi di prodotti biologici.
I cilindri di ossigeno liquefatto sono utilizzati per il taglio e la saldatura dei metalli a temperature elevate. Questi processi sono effettuati negli impianti di macchine da costruzione, in aziende di trasporto e delle costruzioni. Per il lavoro sotto l'acqua, sotterraneo, ad alta quota in un vuoto di persone hanno bisogno la molecola di O 2. bombole di ossigeno sono utilizzati in medicina per arricchire la composizione dell'aria inalata da persone che sono malati. Gas per scopi medici, caratterizzato dalla quasi totale assenza di impurità tecnici, odore.

Ossigeno – l'ossidante perfetta
composto ossigeno noto con tutti gli elementi chimici della tavola periodica, esclusi i primi rappresentanti della famiglia di gas rari. Molte sostanze reagiscono direttamente con atomi di ossigeno, esclusi alogeni, oro e platino. Di grande importanza sono i fenomeni di ossigeno, che sono accompagnati dal rilascio di luce e calore. Tali processi sono ampiamente utilizzati in casa e l'industria. I minerali metallici reagiscono con l'ossigeno chiamati cottura. minerale di pre-macinato viene miscelato con aria arricchita di ossigeno. Alle alte temperature il recupero di metalli da solfuro di sostanze semplici. Così ottenuto ferro e alcuni metalli non ferrosi. La presenza di ossigeno puro aumenta il tasso dei processi produttivi in diversi settori della chimica, ingegneria e metallurgia.
La comparsa di un metodo conveniente per la produzione di ossigeno dall'aria mediante separazione nelle sue componenti a bassa temperatura, ha stimolato lo sviluppo di molti settori della produzione industriale. I chimici credono molecola O 2 e O atomi di agenti ossidanti ideali. Si tratta di materiali naturali, sono costantemente rinnovati in natura, non inquinare l'ambiente. Inoltre, le reazioni chimiche che coinvolgono l'ossigeno spesso finiscono con una sintesi di un altro prodotto naturale e sicuro – acqua. Il ruolo di O 2 nella rimozione di depurazione delle acque reflue industriali tossici dalle impurità. Inoltre ossigeno viene utilizzato per la disinfezione delle sue forme allotropiche – ozono. Questo semplice sostanza possiede elevata attività ossidante. Quando l'ozonizzazione acqua si decompone le sostanze inquinanti. L'ozono è anche effetto negativo sulla microflora patogena.