Termodinamica e trasferimento di calore. Metodi di trasferimento e calcolo del calore. Il trasferimento di calore è …
Oggi cercheremo di trovare la risposta alla domanda "Il trasferimento di calore è …?". Nell'articolo prenderemo in considerazione ciò che il processo è, che tipo di essa esiste nella natura, e anche imparare quale sia il rapporto tra trasferimento di calore e termodinamica.
definizione

Il trasferimento di calore è un processo fisico, la cui essenza è il trasferimento di energia termica. Lo scambio si verifica tra due corpi o il loro sistema. Allo stesso tempo, il trasferimento di calore da corpi più caldi a corpi meno riscaldati è un prerequisito.
Caratteristiche del processo
Il trasferimento di calore è il tipo di fenomeno che può verificarsi sia a contatto diretto che in presenza di partizioni divisorie. Nel primo caso, tutto è chiaro, nel secondo caso i corpi, i materiali e i media possono essere usati come barriere. Il trasferimento di calore si verifica nei casi in cui un sistema costituito da due o più corpi non sia in uno stato di equilibrio termico. Cioè, uno degli oggetti ha una temperatura superiore o inferiore rispetto all'altro. Successivamente viene effettuato il trasferimento di energia termica. È logico supporre che terminerà quando il sistema viene in uno stato di equilibrio termodinamico o termico. Il processo è spontaneo, come possiamo dire la seconda legge della termodinamica.
tipi
Il trasferimento di calore è un processo che può essere suddiviso in tre modi. Saranno di natura fondamentale, in quanto si possono distinguere le sottocategorie reali, che presentano caratteristiche proprie in linea con le leggi generali. Ad oggi è comune distinguere tre tipi di trasferimento di calore. Ciò è conduttività termica, convezione e radiazione. Cominciamo con il primo, forse.
Modalità di trasferimento di calore. Conduttività termica.

Questo è il modo in cui la proprietà di questo o quel corpo materiale è chiamata a svolgere il trasferimento di energia. In questo caso, viene trasferito dalla parte più riscaldata a quella più fredda. Al centro di questo fenomeno sta il principio del moto caotico delle molecole. Questo è il cosiddetto movimento Brownian. Maggiore è la temperatura corporea, più attivi le molecole si muovono in esso, in quanto hanno più energia cinetica. Nel processo di conduttività termica partecipano elettroni, molecole e atomi. Viene eseguito in corpi, le cui diverse parti hanno una temperatura disuguale.
Se la sostanza è capace di condurre il calore, possiamo parlare della presenza di una caratteristica quantitativa. In questo caso il suo ruolo è svolto dal coefficiente di conducibilità termica. Questa caratteristica mostra quanto caldo passerà attraverso l'unità di lunghezza e area per unità di tempo. In questo caso, la temperatura del corpo cambia di esattamente 1 K.
In precedenza si è ritenuto che lo scambio di calore in vari corpi (compreso il trasferimento di calore delle strutture di chiusura) sia dovuto al fatto che da una parte del corpo all'altra fluisce il cosiddetto calore. Tuttavia, nessuno ha mai trovato alcun segno della sua reale esistenza e quando la teoria molecolare-cinetica si sviluppò ad un certo livello, tutti hanno dimenticato di pensare al caldo, dato che l'ipotesi si è rivelata insostenibile.
Convezione. Trasferimento di calore dell'acqua

Con questo metodo di scambio termico si intende la trasmissione mediante flussi interni. Immaginiamo un bollitore con acqua. Come noto, i flussi di aria più scaldanti aumentano verso l'alto. E il freddo, più pesante, scende. Per quale motivo l'acqua dovrebbe essere diversa? È assolutamente lo stesso con lei. E ora nel processo di questo ciclo, tutti gli strati di acqua, non importa quanti, si riscaldano prima dell'insorgenza dello stato di equilibrio termico. Certe condizioni, naturalmente.
radiazione
Questo metodo consiste nel principio della radiazione elettromagnetica. È dovuto all'energia interna. Non entreremo nella teoria della radiazione termica , semplicemente notiamo che la ragione qui è la disposizione delle particelle cariche, degli atomi e delle molecole.
Problemi semplici di conduzione del calore
Ora parliamo di come il calcolo del trasferimento di calore sembra in pratica. Risolviamo un semplice compito legato alla quantità di calore. Diciamo che abbiamo una massa d'acqua pari a mezzo chilogrammo. La temperatura dell'acqua iniziale è di 0 gradi Celsius, la temperatura finale è di 100. Trovaamo la quantità di calore che abbiamo speso per riscaldare questa massa di materia.
Per questo abbiamo bisogno della formula Q = cm (t 2 -t 1 ), dove Q è la quantità di calore, c è il calore specifico dell'acqua, m è la massa della sostanza, t 1 è l'iniziale, t 2 è la temperatura finale. Per l'acqua, il valore di c è tabulare. La capacità termica specifica sarà di 4200 J / kg * C. Ora sostituite questi valori nella formula. Prendiamo che la quantità di calore sarà pari a 210000 J, o 210 kJ.
La prima legge della termodinamica

La termodinamica e il trasferimento di calore sono legati tra loro da alcune leggi. Essi si basano sulla conoscenza che i cambiamenti nell'energia interna all'interno del sistema possono essere ottenuti con due metodi. Il primo – l'adempimento del lavoro meccanico. Il secondo è il messaggio di una certa quantità di calore. A proposito, questo principio si basa sulla prima legge della termodinamica. Ecco la sua formulazione: se il sistema è stato informato di una certa quantità di calore, sarà speso per fare lavoro su corpi esterni o per incrementare l'energia interna. Denominazione matematica: dQ = dU + dA.
Pro o contro?
Assolutamente tutte le quantità che entrano nella notazione matematica della prima legge della termodinamica possono essere scritte con un segno più e un segno meno. E la loro scelta sarà dettata dalle condizioni del processo. Supponiamo che il sistema riceva una certa quantità di calore. In questo caso, i corpi in esso vengono riscaldati. Di conseguenza, l'espansione del gas avviene, il che significa che il lavoro è in corso. Di conseguenza, i valori saranno positivi. Se la quantità di calore viene tolto, il gas si raffredda, il lavoro viene eseguito sopra di esso. I valori avranno valori opposti.
Formulazione alternativa della prima legge della termodinamica
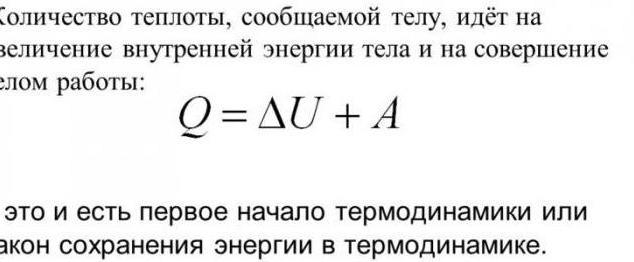
Supponiamo di avere un motore a funzionamento periodico. In esso, il corpo (o sistema) di lavoro svolge un processo circolare. Di solito viene chiamato ciclo. Di conseguenza, il sistema tornerà allo stato originale. Sarebbe logico supporre che in questo caso la variazione dell'energia interna sarà zero. Si scopre che la quantità di calore sarà uguale al lavoro perfetto. Queste disposizioni consentono di formulare in modo diverso la prima legge della termodinamica.
Da noi possiamo capire che in natura non esiste una macchina perpetua di movimento del primo tipo. Cioè, un dispositivo che fa più lavoro rispetto all'energia ricevuta dall'esterno. In questo caso, le azioni devono essere eseguite periodicamente.
La prima legge di termodinamica per isoprocessi
Prendiamo innanzitutto in considerazione il processo ischerico. Con esso, il volume rimane costante. Così, il cambiamento di volume sarà zero. Di conseguenza, il lavoro sarà anche zero. Lasciamo questo termine dalla prima legge della termodinamica, dopo di che otteniamo la formula dQ = dU. Quindi, in un processo isochorico, tutto il calore fornito al sistema va a aumentare l'energia interna del gas o della miscela.
Ora parliamo del processo isobarico. Il valore costante rimane la pressione. In questo caso, l'energia interna cambia in parallelo con il lavoro. Ecco la formula originale: dQ = dU + pdV. Possiamo facilmente calcolare il lavoro svolto. Sarà uguale all'espressione uR (T 2 -T 1 ). A proposito, questo è il significato fisico della costante universale del gas. In presenza di un mole di gas e di una differenza di temperatura di un Kelvin, la costante del gas universale sarà uguale al lavoro eseguito nel processo isobarico.