Alogeni – it … composti alogenati
Qui il lettore troverà informazioni sul alone, gli elementi chimici della tavola periodica D. I. Mendeleeva. Il contenuto di questo articolo vi permetterà di acquisire familiarità con le loro proprietà chimiche e fisiche, stare nella natura, le modalità di applicazione e di altri.
informazioni generali
Alogeni – tutti gli elementi del chimico della tavola periodica che sono nel gruppo XVII. Secondo un metodo per classificare stroma sono tutti gli elementi del settimo gruppo, i principali sottogruppi.
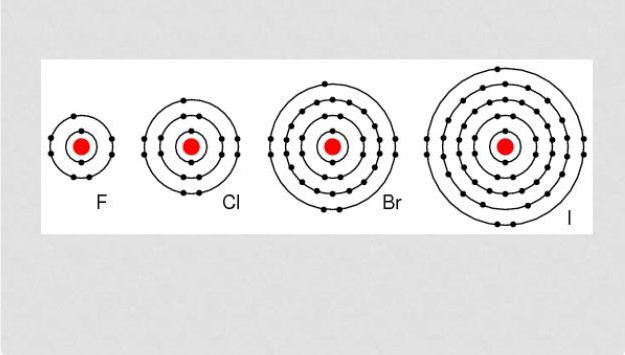
Alogeno – sono elementi in grado di reagire con quasi tutte le sostanze tipo semplice tranne una certa quantità di non metalli. Tutti questi sono ossidanti energia, poiché nelle condizioni di natura, tendono ad essere in forma mista con altre sostanze. alogeni indicatore reattività diminuisce con l'aumentare della loro numerazione ordinale.
Alogeni seguenti elementi: fluoro, cloro, bromo, iodio, astato e tennesin creato artificialmente.
Come accennato in precedenza, tutti gli alogeni – è ossidante con proprietà distinte, oltre a tutti sono non metalli. Esterno livello di energia ha sette elettroni. Interazione con metalli porta alla formazione di un legame ionico e sali. Quasi tutti gli alogenuri tranne fluoro, possono manifestarsi come agente riducente, il grado ossidante culmina 7, ma questo richiede che interagiscono con elementi avente un maggior grado di elettronegatività.
Caratteristiche etimologia

Nel 1841, chimico svedese J. Berzelius proposto l'introduzione del termine alogeno, riferendosi a loro noto al momento F, Br, I. Tuttavia, fino all'introduzione del termine in relazione all'intero gruppo di elementi, nel 1811, scienziato tedesco e . Shveygger parola chiamata stesso termine cloro stessa tradotto dal greco come "solerod".
struttura atomica e il grado di ossidazione
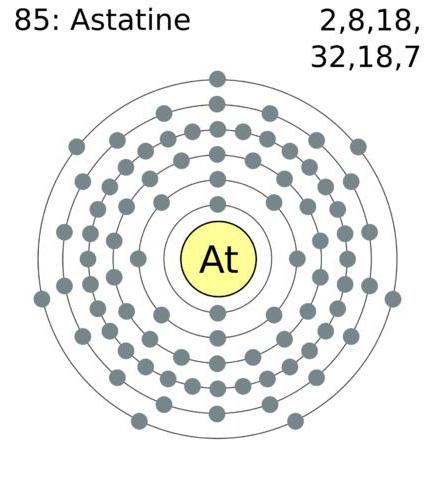
La configurazione del guscio elettronico esterno alogeno atomica è: astato – 6s 2 6p 5 iodo – 5s 5p 2 5 2 4p 4s bromo 5 cloro – 3s 3p 5 2, 2s fluoro 2 2p 5.
Alogeno – gli elementi avente sulla esterno elettroni shell tipo sette elettroni che permette loro di "sforzo" attribuiscono guscio elettronico che è insufficiente per la completa. Tipicamente, il grado di ossidazione si manifesta come -1. Cl, Br, I e A reagire con elementi aventi un grado più elevato, cominciano a mostrare un grado di ossidazione positivo +1, +3, +5 e +7. Fluoruro ha un livello costante di ossidativo -1.
diffusione
A causa della loro elevata reattività di alogeni sono di solito sotto forma di composti. Prevalenza nella crosta terrestre diminuisce in conformità con aumento del raggio atomico da F a I. astato nella crosta terrestre a tutti misurati in grammi e tennessin creati artificialmente.
Alogenuri si trovano in natura più spesso nei composti di alogenuri, e iodio possono anche assumere la forma di ioduro di potassio o di sodio. Grazie alla sua solubilità in acqua presente nelle acque oceaniche e salamoie di origine naturale. La F – scarsamente rappresentativo di alogeno e più spesso si trovano in rocce di tipo sedimentario, e la sua fonte principale – un fluoruro di calcio.
Caratteristiche fisiche di qualità
Alogeni con l'altro può essere molto diverso, ed hanno le seguenti caratteristiche fisiche:
- Fluoro (F2) – un gas di colore giallo chiaro, ha un odore acuto e irritante, e non sono sottoposti a compressione in condizioni normali di temperatura. Il punto di fusione è -220 ° C e il punto di ebollizione -188 ° C.
- Cloro (Cl 2) è un gas non comprimibile a temperatura ambiente, anche sotto pressione, ha un soffocante odore pungente e un colore giallo-verde. Fusione comincia a -101 ° C e far bollire a -34 ° C.
- Bromo (Br 2), – un liquido volatile e pesante, con un colore marrone-bruno e fetido odore acuto. Fonde a -7 ° C e bolle a 58 ° C.
- Iodio (I 2) – un agente di tipo solido ha un colore grigio scuro, ed è caratteristico lucentezza metallica, odore molto forte. processo di fusione inizia quando il 113,5 ° C e bolle a 184.885 ° C.
- Rare halo – è astato (At 2), che è un solido e ha un colore blu-nero con riflessi metallici. Il punto di fusione corrisponde a circa 244 ° C, punto di ebollizione inizia e dopo aver raggiunto 309 ° C.
La natura chimica di alogeni
Alogeno – gli elementi con elevata attività ossidativa che diminuisce nella direzione da F a At. Fluoro, come rappresentante più attivo di alogeni, può reagire con tutti i tipi di metalli, senza escludere qualsiasi noto. La maggior parte rappresentanti metalli entrano nell'atmosfera di fluoro subiscono combustione spontanea, liberando così il calore in grandi quantità.
Senza sottoporlo riscaldamento fluoro può reagire con un sacco di non metalli, come H2, C, P, S, Si. Il tipo di reazione in questo caso è esotermica e può essere accompagnata da un'esplosione. Riscaldata, F conduce per ossidare l'alogeno residuo, ed essendo esposti a radiazioni, l'elemento è in grado di e reagisce con i gas pesanti natura inerte.
Quando interagiscono con i composti di tipo complesso, fluoro è una reazione altamente energetico, ad esempio acqua ossidanti, può causare esplosioni.

Il reattivo può anche essere cloro, in particolare allo stato libero. livello di attività inferiore fluoro, ma è in grado di reagire con quasi tutte le sostanze semplici, ma azoto, ossigeno e gas nobili non reagiscono con esso. Interagendo con idrogeno, riscaldando il cloro o buona illuminazione crea burnoprotekayuschuyu reazione accompagnata da esplosione.
Nelle reazioni di addizione e sostituzione Cl può reagire con un sacco di sostanze di tipo complesso. Atto a spostare Br e I mediante riscaldamento di un composto creato da loro con un metallo o idrogeno, e può anche reagire con sostanze alcaline.
Bromo chimicamente meno attivo di cloro o fluoro, ma si manifesta chiaramente. Questo perché la maggior parte di bromo Br è usato come liquido, poiché in questa condizione il grado di concentrazione iniziale a parità di altre condizioni superiori Cl. Ampiamente usato in chimica, in particolare organica. Esso può essere sciolto in H 2 O e parzialmente reagire con esso.
alogeno-iodo forma una sostanza semplice I 2 e in grado di reagire con H 2 O, disciolto nella soluzione di ioduro, formando anioni complessi. La maggior parte di alogeno I differenzia in quanto non reagisce con la maggioranza dei rappresentanti dei non-metalli e reagisce lentamente con metalli, in questo caso è necessario riscaldare. Poiché l'idrogeno reagisce solo esposto a calore intenso, e la reazione è endotermica.
astato alogeno rare (A) presenta reattività dei meno iodio, ma può reagire con metalli. Come risultato di dissociazione verificarsi sia anioni e cationi.
applicazioni
composti alogenati sono ampiamente utilizzati dall'uomo in una varietà di settori. criolite naturale (Na 3 AlF 6) viene utilizzato per preparare Al. Bromo e iodio sostanze come semplici comunemente utilizzati farmaceutiche e aziende chimiche. Nella produzione di componenti auto spesso utilizzano alogeno. Lights – questa è una di quelle parti. Qualitativamente scegliere il materiale per questa parte della macchina è molto importante, come i fari illuminano la strada di notte, e un metodo per rilevare voi e per gli altri automobilisti. Uno dei migliori materiali compositi per creare fari allo xeno considerati. Alogena, tuttavia, un po 'di qualità inferiore al gas inerte.

Buona alone – è fluoro, un additivo comunemente usato nella produzione di dentifrici. Aiuta a prevenire l'insorgenza di malattie dentali – carie dentale.
Tale elemento alogeno come cloro (Cl), trova la sua applicazione nella preparazione HCl, spesso utilizzato nella sintesi di sostanze organiche, come plastica, gomma, fibre sintetiche, coloranti e solventi e simili. D. E anche i composti del cloro sono usati come agenti sbiancanti lino e cotone materiale, carta, e come mezzo di controllo batteri nell'acqua potabile.

Attenzione! Toxic!
In considerazione della elevata reattività di alogeni giustamente definito tossico. Questo è più chiaramente la capacità di unire la reazione espressa in fluoro. Alogeni hanno proprietà forti e soffocanti capaci di impegnare interazione tissutale.
Fluoruro in coppie e aerosol è considerato una delle forme più potenzialmente pericolosi di alogeno dannoso per gli altri esseri viventi. Ciò è dovuto al fatto che essa è mal percepito dall'olfatto e sentire solo al raggiungimento di alte concentrazioni.
Riassumendo
Come si vede, gli alogeni sono una parte molto importante della tavola periodica, hanno molte proprietà che differiscono in qualità fisiche e chimiche, struttura atomica, il grado di ossidazione e la capacità di reagire con i metalli e non metalli. L'industria utilizza una varietà di modi, che vanno dagli additivi nei prodotti per l'igiene personale e finitura sostanze sintesi chimica organica o candeggianti. Nonostante il fatto che uno dei modi migliori per mantenere e creare luce nel faro di veicolo è xeno, alogeno, tuttavia non è inferiore ed è anche ampiamente utilizzato ed ha i suoi vantaggi.
Ora sapete cosa un alone. Cruciverba con domande su queste sostanze per voi non sono più un ostacolo.










