L'anodo e catodo – che cosa è e come identificare?
Circa l'anodo e il catodo di alimentazione è necessario sapere chi è impegnato in elettronica pratici. Cosa e come si chiama? Perché così? Sarà approfondita considerazione del tema dal punto di vista non solo radio amatoriali, ma anche la chimica. La spiegazione più popolare è la seguente: anodo – un elettrodo positivo, e il catodo – negativo. Purtroppo, questo non è sempre vero e incompleta. Per essere in grado di definire l'anodo e il catodo, è necessario avere una base teorica e sapere che come un sì. Esaminiamo questo articolo.
anodo
 Facendo riferimento alla GOST 15.596-82, che è impegnata nella chimica generatori di corrente. Siamo interessati a informazioni posta sulla terza pagina. Secondo GOST, l'elettrodo negativo della cella elettrochimica è esattamente l'anodo. Che è così, sì! E perché così? Il fatto è che attraverso di essa la corrente elettrica viene dal circuito esterno alla sorgente stessa. Come si può vedere, non è così facile come sembra a prima vista. Può essere opportuno considerare con attenzione il quadro presentato in questo articolo, se il contenuto sembra troppo complicato – che vi aiuterà a capire ciò che l'autore vuole trasmettere a voi.
Facendo riferimento alla GOST 15.596-82, che è impegnata nella chimica generatori di corrente. Siamo interessati a informazioni posta sulla terza pagina. Secondo GOST, l'elettrodo negativo della cella elettrochimica è esattamente l'anodo. Che è così, sì! E perché così? Il fatto è che attraverso di essa la corrente elettrica viene dal circuito esterno alla sorgente stessa. Come si può vedere, non è così facile come sembra a prima vista. Può essere opportuno considerare con attenzione il quadro presentato in questo articolo, se il contenuto sembra troppo complicato – che vi aiuterà a capire ciò che l'autore vuole trasmettere a voi.
catodico
Ci rivolgiamo tutti allo stesso GOST 15.596-82. L'elettrodo positivo della cella elettrochimica è che, allo scarico da cui esce nel circuito esterno. Come si può vedere, i dati contenuti nelle norme CEI 15.596-82, vista la situazione da una posizione diversa. Pertanto, in consultazione con gli altri su determinate strutture hanno bisogno di essere molto attenti.
Il verificarsi di condizioni
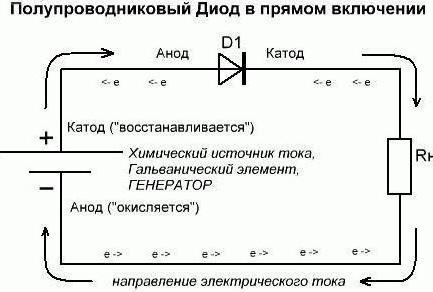 Hanno introdotto più Faraday nel mese di gennaio 1834, per evitare confusione e per ottenere una maggiore precisione. Ha offerto la sua versione, e ricordando l'esempio del sole. Così, lui ha un anodo – è in aumento. Sole si sposta verso l'alto (corrente entra). Cathode – è impostato. Il sole va giù (corrente a).
Hanno introdotto più Faraday nel mese di gennaio 1834, per evitare confusione e per ottenere una maggiore precisione. Ha offerto la sua versione, e ricordando l'esempio del sole. Così, lui ha un anodo – è in aumento. Sole si sposta verso l'alto (corrente entra). Cathode – è impostato. Il sole va giù (corrente a).
tubi radiofonici e ESEMPIO diodo
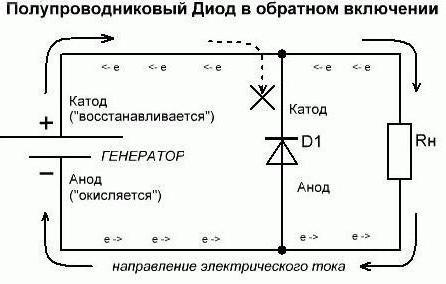 Continuiamo a capire che per riferirsi a ciò che viene utilizzato. Supponiamo che uno dei il potere che abbiamo questi consumatori in uno stato aperto (in vivo). Così, dal circuito esterno da un diodo membro anodo è corrente elettrica. Ma non essere confuso a causa di questa spiegazione dalla direzione dell'elettrone. Attraverso il catodo in un circuito esterno delle uscite elettriche dell'elemento corrente utilizzata. Una situazione che si è sviluppato oggi, ricorda i casi in cui le persone guardano il modello invertito. Se i dati si riferiscono al complesso – ricordate che per capire loro in questo modo necessariamente esclusivamente per i chimici. E ora facciamo l'inclusione inversa. Si può notare che i diodi semiconduttori praticamente non condurre corrente. L'unica possibile eccezione qui – gli elementi di rottura inversa. Un diodo a vuoto (kenotron, radio) non sarà generalmente condurre corrente inversa. Pertanto, considerato (arbitrariamente) che non passa attraverso di loro. Pertanto, le conclusioni formali presso l'anodo e il catodo diodo non svolgono le loro funzioni.
Continuiamo a capire che per riferirsi a ciò che viene utilizzato. Supponiamo che uno dei il potere che abbiamo questi consumatori in uno stato aperto (in vivo). Così, dal circuito esterno da un diodo membro anodo è corrente elettrica. Ma non essere confuso a causa di questa spiegazione dalla direzione dell'elettrone. Attraverso il catodo in un circuito esterno delle uscite elettriche dell'elemento corrente utilizzata. Una situazione che si è sviluppato oggi, ricorda i casi in cui le persone guardano il modello invertito. Se i dati si riferiscono al complesso – ricordate che per capire loro in questo modo necessariamente esclusivamente per i chimici. E ora facciamo l'inclusione inversa. Si può notare che i diodi semiconduttori praticamente non condurre corrente. L'unica possibile eccezione qui – gli elementi di rottura inversa. Un diodo a vuoto (kenotron, radio) non sarà generalmente condurre corrente inversa. Pertanto, considerato (arbitrariamente) che non passa attraverso di loro. Pertanto, le conclusioni formali presso l'anodo e il catodo diodo non svolgono le loro funzioni.
Perché c'è confusione?
In particolare, al fine di facilitare l'apprendimento e l'applicazione pratica, è stato deciso che gli elementi di nome di terminali a diodi non cambieranno indipendentemente dal tipo di connessione, e saranno "attaccato" per i risultati fisici. Ma questo non vale per le batterie. Così, nei diodi semiconduttori tutto dipende dal tipo di conduttività del cristallo. I tubi a vuoto che interrogano è destinata a un elettrodo che emette elettroni al posto della disposizione filamento. Naturalmente, qui ci sono alcune sfumature: per esempio, attraverso tali dispositivi a semiconduttore, come un soppressore ed un diodo zener può essere un po 'di flusso di corrente inversa, ma qui ci sono specifiche, chiaramente oltre la portata di questo articolo.
Indagato con accumulatore elettrico
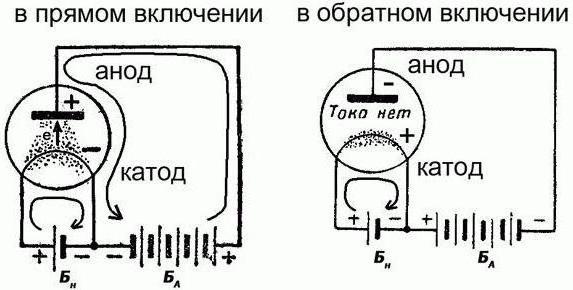 Questo è veramente un classico esempio di una fonte chimica di corrente elettrica, che è rinnovabile. La batteria è in uno di due modi: la carica / scarica. In entrambi i casi sarà differente direzione della corrente elettrica. Ma si noti che la polarità degli elettrodi, allo stesso tempo non cambierà. E possono agire in diversi ruoli:
Questo è veramente un classico esempio di una fonte chimica di corrente elettrica, che è rinnovabile. La batteria è in uno di due modi: la carica / scarica. In entrambi i casi sarà differente direzione della corrente elettrica. Ma si noti che la polarità degli elettrodi, allo stesso tempo non cambierà. E possono agire in diversi ruoli:
- Durante la carica, l'elettrodo positivo accetta la corrente elettrica e un anodo e il suo negativo e rilascia la chiamata catodo.
- In assenza di movimento su di loro per condurre una conversazione non ha senso.
- Durante la scarica dell'elettrodo positivo rilascia una corrente elettrica ed un catodo, e il negativo riceve e viene chiamato anodo.
Su Elettrochimica dire una parola
Esso utilizza una definizione leggermente diversa. Così, l'anodo è considerato come un elettrodo dove avvengono i processi di ossidazione. E naturalmente la scuola ricordo di chimica, si può rispondere che cosa sta accadendo dall'altra parte? L'elettrodo su cui i processi recupero, chiamato il catodo. Ma non v'è alcun riferimento ai dispositivi elettronici. Diamo un'occhiata al valore delle reazioni di ossido-riduzione a noi:
- Ossidazione. C'è un processo di ritorno di una particella dell'elettrone. Neutro si trasforma in uno ione positivo e il negativo viene neutralizzata.
- Recovery. Il processo per ottenere una particella di elettroni. trasformato positivo in uno ione neutra, e poi negativo iterazione.
- I due processi sono interdipendenti (ad esempio, il numero di elettroni che, data uguale ADJOINT loro numero).
Faraday anche per indicare i nomi sono stati introdotti per gli elementi che intervengono nelle reazioni chimiche:
- Cationi. Cosiddetta ioni positivamente che si muovono in carica la soluzione elettrolitica al polo negativo (catodo).
- Anioni. Così hanno chiamato ioni negativi che si muovono nella soluzione elettrolitica nel polo positivo (anodo).
Come reazioni chimiche avvengono?
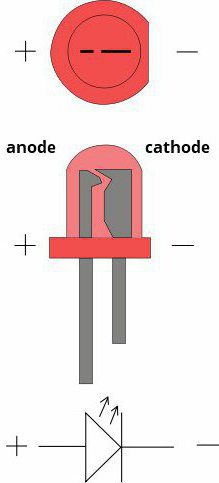 Ossidazione e riduzione semireazioni sono separati nello spazio. Il passaggio di elettroni tra il catodo e l'anodo è effettuata non direttamente, ma attraverso un conduttore circuito esterno, che crea una corrente elettrica. Qui si può osservare interconversione di forme chimiche ed elettriche di energia. Pertanto, per formare un sistema di circuito esterno dei conduttori di varia natura (che è ciò che gli elettrodi nella elettrolita), ed è necessario usare il metallo. Vedere, la tensione tra l'anodo e il catodo esiste come un avvertimento. E se c'era alcun elemento che impedisce loro direttamente per rendere il processo necessario, il valore delle sorgenti di corrente chimici sarebbe molto basso. E così, grazie al fatto che la carica è necessario camminare sul regime, raccolto e lavorato come tecnico.
Ossidazione e riduzione semireazioni sono separati nello spazio. Il passaggio di elettroni tra il catodo e l'anodo è effettuata non direttamente, ma attraverso un conduttore circuito esterno, che crea una corrente elettrica. Qui si può osservare interconversione di forme chimiche ed elettriche di energia. Pertanto, per formare un sistema di circuito esterno dei conduttori di varia natura (che è ciò che gli elettrodi nella elettrolita), ed è necessario usare il metallo. Vedere, la tensione tra l'anodo e il catodo esiste come un avvertimento. E se c'era alcun elemento che impedisce loro direttamente per rendere il processo necessario, il valore delle sorgenti di corrente chimici sarebbe molto basso. E così, grazie al fatto che la carica è necessario camminare sul regime, raccolto e lavorato come tecnico.
Di cosa si tratta: Fase 1
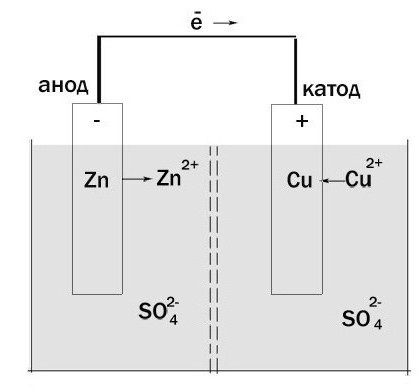 Ora cerchiamo di determinare quale è quale. Prendete un galvanica cella-Jacobi Daniel. Da un lato consiste dell'elettrodo di zinco, che è immersa in una soluzione di solfato di zinco. Poi v'è una barriera porosa. E d'altra parte ha un elettrodo di rame che è disposto in una soluzione di solfato di rame. Sono in contatto con l'altro, ma le caratteristiche chimiche e il setto non danno si mescolano.
Ora cerchiamo di determinare quale è quale. Prendete un galvanica cella-Jacobi Daniel. Da un lato consiste dell'elettrodo di zinco, che è immersa in una soluzione di solfato di zinco. Poi v'è una barriera porosa. E d'altra parte ha un elettrodo di rame che è disposto in una soluzione di solfato di rame. Sono in contatto con l'altro, ma le caratteristiche chimiche e il setto non danno si mescolano.
Fase 2: Processo
ossidazione avviene zinco e gli elettroni si muovono attraverso un circuito esterno al rame. Così si scopre che la cella elettrochimica ha un anodo, carica negativa, e il catodo – il positivo. Inoltre, questo processo può avvenire solo nei casi in cui gli elettroni è dove "go". Il fatto è che per ottenere direttamente dal elettrodo all'altro impedisce l'esistenza di "isolamento".
Fase 3: Elettrolisi
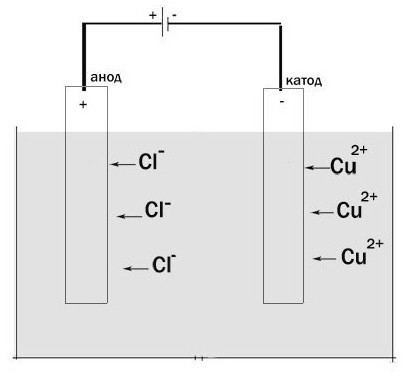 Diamo un'occhiata al processo di elettrolisi. Installazione per il suo passaggio è un vaso in cui v'è una soluzione elettrolitica o fusione. L'elettrodo ha due omesso. Essi sono collegati ad una fonte di alimentazione CC. L'anodo in questo caso – è l'elettrodo che è collegato al polo positivo. Qui è ossidato. Un elettrodo caricato negativamente – il catodo è. Qui, una reazione di riduzione ha luogo.
Diamo un'occhiata al processo di elettrolisi. Installazione per il suo passaggio è un vaso in cui v'è una soluzione elettrolitica o fusione. L'elettrodo ha due omesso. Essi sono collegati ad una fonte di alimentazione CC. L'anodo in questo caso – è l'elettrodo che è collegato al polo positivo. Qui è ossidato. Un elettrodo caricato negativamente – il catodo è. Qui, una reazione di riduzione ha luogo.
Fase 4: Finalmente
Pertanto, quando si opera questi concetti devono sempre essere tenuto presente che l'anodo non è nel 100% dei casi usati per denotare un elettrodo negativo. Inoltre, il catodo possono perdere la loro carica positiva. Tutto dipende dal tipo di processo ha luogo in corrispondenza dell'elettrodo: una riduzione o ossidazione.
conclusione
Questo è tutto questo è – non è molto difficile, ma non si può dire così semplice. Abbiamo considerato una cella galvanica, l'anodo e il catodo in termini di regime, e ora i problemi con la connessione al tempo di funzionamento alimentazione non si dovrebbe essere. E, infine, è necessario lasciare un po 'di più prezioso per voi le informazioni. avere sempre presente la differenza, che ha il potenziale del catodo / il potenziale dell'anodo. Il fatto che il primo sarà sempre un po 'grande. Ciò è dovuto al fatto che l'efficienza non funziona con la cifra di 100% e una porzione della carica viene dissipata. È a causa di questo si può vedere che le batterie hanno un limite al numero di volte di carica e scarica.













