Cosa contiene la proteina? Esempi di proteine semplici e complesse
Immaginare l'importanza delle proteine basta ricordare la nota frase di Friedrich Engels: "La vita è un modo di esistenza di corpi proteici". Infatti, sulla Terra queste sostanze insieme agli acidi nucleici causano tutte le manifestazioni della materia vivente. In questo articolo, scopriremo cosa costituisce la proteina, studieremo la funzione che esegue e determineremo anche le caratteristiche della struttura di varie specie.
Peptidi – polimeri altamente organizzati
Infatti, in una cellula vivente, sia vegetale che animale, le proteine predominano su altre sostanze organiche e svolgono anche il maggior numero di funzioni diverse. Essi partecipano ad una serie di processi cellulari molto importanti, come il movimento, la difesa, la segnalazione e così via. Ad esempio, nel tessuto muscolare di animali e di esseri umani, i peptidi costituiscono fino all'85% della massa di materia secca, e nell'osso e nel derma, dal 15-50%.
Tutte le proteine cellulari e tessuti sono costituite da aminoacidi (20 specie). Il loro numero negli organismi viventi è sempre di 20 tipi. Diverse combinazioni di monomeri peptidi costituiscono una varietà di proteine in natura. È calcolato da un numero astronomico di 2×10 18 possibili specie. Nella biochimica, i polipeptidi sono chiamati polimeri biologici ad alta molecola, macromolecole.
Aminoacidi – monomeri di proteine
Tutti i 20 tipi di questi composti chimici sono unità strutturali di proteine e hanno la formula generale NH2-R-COOH. Sono sostanze organiche amfoteriche in grado di esporre sia proprietà basiche che acide. Non solo proteine semplici, ma anche complesse, contengono cosiddetti aminoacidi non essenziali. Ma monomeri indispensabili, ad esempio come valine, lisina, metionina possono essere trovati solo in alcuni tipi di proteine. Tali proteine sono chiamate piene.
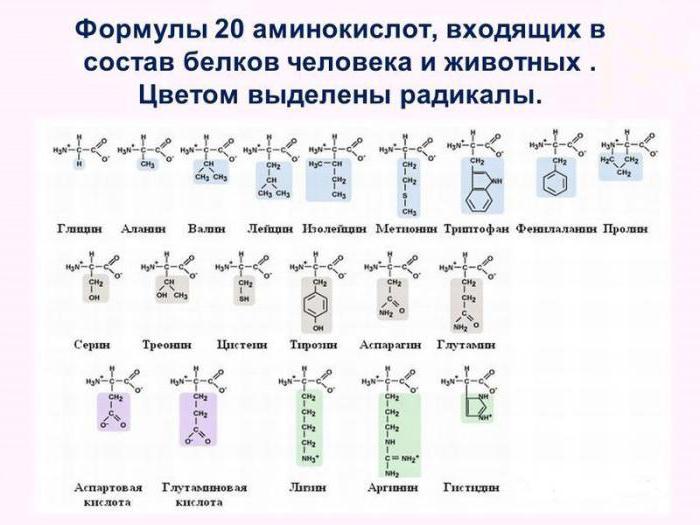
Pertanto, caratterizzare il polimero tiene conto non solo di quanti aminoacidi la proteina è costituita, ma anche quali monomeri sono collegati da legami peptidici alla macromolecola. Inoltre aggiungiamo che gli amminoacidi intercambiabili, come l'asparagine, l'acido glutammico, la cisteina possono essere sintetizzati indipendentemente nelle cellule umane e animali. Monomeri proteici insostenibili si formano nelle cellule di batteri, piante e funghi. Entrano negli organismi eterotrofi solo con il cibo.
Come si forma il polipeptide
Come sapete, 20 differenti aminoacidi possono essere combinati in molte molecole proteiche diverse. Come si verifica tra loro i legami dei monomeri? Si scopre che i gruppi carbossilici e amminici di un certo numero di aminoacidi mentali interagiscono tra loro. I cosiddetti legami peptidici vengono formati e le molecole d'acqua vengono rilasciate come sottoprodotto della reazione di policondensazione. Le molecole proteiche formate sono costituite da residui di amminoacidi e da legami peptidici ripetutamente ricorrenti. Quindi sono anche chiamati polipeptidi.
Spesso, le proteine possono contenere non una ma diverse catene di polipeptidi e sono costituite da migliaia di residui di amminoacidi. Inoltre, le proteine semplici, così come le proteine, possono complicare la loro configurazione spaziale. Ciò crea non solo una struttura primaria, ma anche secondaria, terziaria e anche quaternaria. Consideriamo questo processo in modo più dettagliato. Continuando a studiare la domanda: che cosa costituisce la proteina, quale è la configurazione di questa macromolecola. Abbiamo stabilito che la catena del polipeptide contiene una serie di legami chimici covalenti. È questa struttura che si chiama primaria.
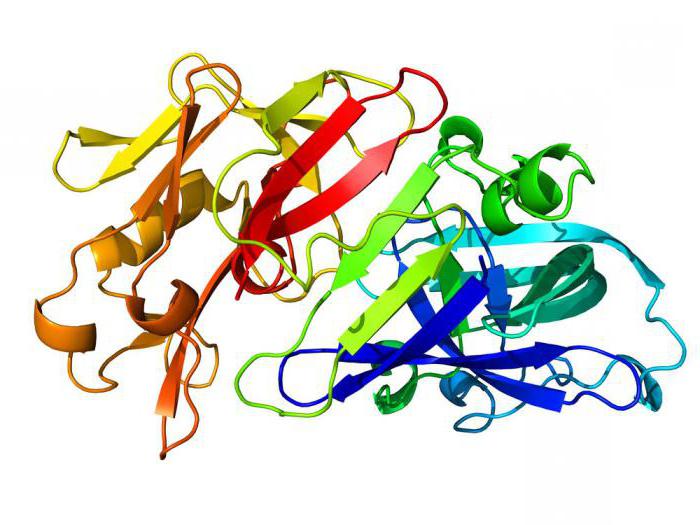
Esso svolge un ruolo importante nella composizione quantitativa e qualitativa degli aminoacidi, nonché nella sequenza della loro connessione. La struttura secondaria si verifica al momento della formazione della spirale. È stabilizzata da molti nuovi legami di idrogeno emergenti.
Livelli più elevati di organizzazione proteica
La struttura terziaria appare come un impacco di una spirale sotto forma di globula, ad esempio, la proteina proteica muscolare ha una struttura spaziale tale. È mantenuto da entrambi i legami di idrogeno di nuova costituzione e ponti di disolfuro (se diversi residui di cisteina entrano nella molecola proteica). La forma quaternaria è il risultato della combinazione di più globuli proteici in una singola struttura contemporaneamente per mezzo di nuovi tipi di interazioni, ad esempio, idrofobiche o elettrostatiche. Oltre ai peptidi, anche le parti non proteiche entrano nella struttura quaternaria. Possono essere ioni di magnesio, ferro, rame o residui di ortofosfato o acidi nucleici, nonché lipidi.
Caratteristiche della biosintesi proteica
In precedenza abbiamo scoperto che cosa consiste la proteina. È costruito da una sequenza di aminoacidi. Il loro assemblaggio in una catena di polipeptidi si verifica nei ribosomi – organelle non membraniche di piante e cellule animali. Molte molecole di informazione e trasporto RNA partecipano anche al processo di biosintesi. La prima è la matrice per l'assemblaggio di proteine e il secondo trasportano vari amminoacidi. Nel processo di biosintesi cellulare, sorge un dilemma, vale a dire che la proteina è costituita da nucleotidi o aminoacidi? La risposta è inequivocabile – i polipeptidi, sia semplici che complessi, sono costituiti da composti organici amfoterici – aminoacidi. Nel ciclo di vita della cellula, ci sono periodi della sua attività, quando la sintesi delle proteine è particolarmente attiva. Queste sono le cosiddette tappe J1 e J2 dell'interfaccia. A questo punto, la cellula sta crescendo attivamente e ha bisogno di un sacco di materiale da costruzione, che è proteina. Inoltre, a seguito della mitosi, che termina con la formazione di due cellule figlia, ognuno di loro ha bisogno di una grande quantità di sostanze organiche, quindi canali attivi di lipidi e carboidrati sono sintetizzati sui canali del reticolo liscio endoplasmatico e la biosintesi proteica si verifica sulla EPS granulare. 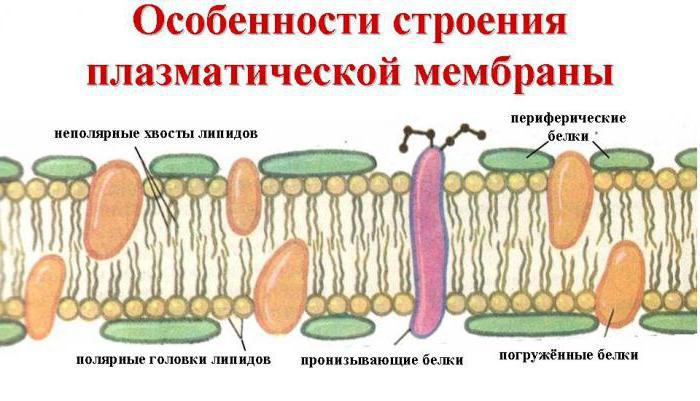
Funzioni di proteine
Conoscendo che cosa consiste la proteina, si può spiegare sia l'enorme varietà delle loro specie che le proprietà uniche inerenti a queste sostanze. Le proteine svolgono una varietà di funzioni nella cella, per esempio la costruzione, in quanto fanno parte delle membrane di tutte le cellule e degli organoidi: i mitocondri, i cloroplasti, i lisosomi, il complesso Golgi e così via. Tali peptidi come gamoglobuline o anticorpi sono esempi di semplici proteine che svolgono una funzione protettiva. In altre parole, l'immunità cellulare è il risultato dell'azione di queste sostanze. La proteina complessa – l'emociano, insieme all'emoglobina, esegue negli animali la funzione di trasporto, ossia porta ossigeno nel sangue. Le proteine del segnale che compongono le membrane cellulari forniscono informazioni alla cellula stessa sulle sostanze che cercano di entrare nel suo citoplasma. L'albumina del peptide è responsabile dei parametri di base del sangue, ad esempio, per la sua capacità di coagulazione. La proteina di uova di gallina è conservata in una gabbia e serve come principale fonte di nutrienti.

Le proteine sono la base del citoscheletro della cellula
Una delle funzioni importanti dei peptidi è quella di supporto. È molto importante per preservare la forma e il volume delle cellule viventi. Le cosiddette strutture sotto-membrane – microtubuli e microfilamenti che intrecciano formano lo scheletro interno della cellula. Le proteine che costituiscono la loro composizione, ad esempio tubulina, possono facilmente contrattare e allungarsi. Ciò aiuta la cella a mantenere la sua forma sotto varie deformazioni meccaniche.
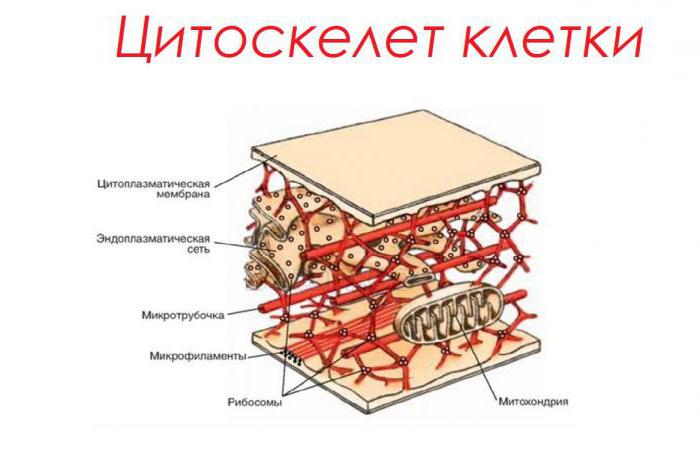
Nelle cellule vegetali, insieme alle proteine del ialoplasma, i tratti citoplasmatici – plasmodesmi hanno anche una funzione di supporto. Passando attraverso i pori nella parete cellulare, essi causano la relazione tra una serie di strutture cellulari mentire che formano tessuti vegetali.
Gli enzimi sono sostanze di natura proteica
Una delle proprietà più importanti delle proteine è il loro effetto sul tasso di reazioni chimiche. Le principali proteine sono in grado di denaturare parzialmente – il processo di svolgimento della macromolecola nella struttura terziaria o quaternaria. La catena del polipeptide non si rompe. La denaturazione parziale si basa sia sul segnale che sulle funzioni catalitiche della proteina. L'ultima proprietà è la capacità degli enzimi di influenzare il tasso di reazioni biochimiche nel nucleo e nel citoplasma della cellula. I peptidi che, al contrario, riducono la velocità dei processi chimici sono solitamente chiamati non inibitori, ma enzimi. Ad esempio, una semplice proteina catalasi è un enzima che accelera la scissione della sostanza tossica del perossido di idrogeno. È formato come prodotto finale di molte reazioni chimiche. Catalase accelera la sua utilizzazione a sostanze neutre: acqua e ossigeno.
Proprietà delle proteine
I peptidi sono classificati da molte caratteristiche. Ad esempio, in relazione all'acqua, possono essere suddivisi in idrofili e idrofobi. La temperatura influenza anche la struttura e le proprietà delle molecole proteiche in modi diversi. Ad esempio, la cheratina proteica – un componente di unghie e capelli può sopportare sia le basse che le alte temperature, cioè è termolabile. Ma l'ovalbumina di proteine, già menzionata in precedenza, quando riscaldata a 80-100 ° C completamente distrutta. Ciò significa che la sua struttura primaria si divide in residui di amminoacidi. Questo processo è chiamato distruzione. Qualunque siano le condizioni che creiamo, la proteina non può tornare alla forma nativa. Le proteine del motore – l'actina e il milosin sono presenti nelle fibre muscolari. La loro riduzione alternativa e il rilassamento sono al centro del lavoro del tessuto muscolare.















