Il grado di ossidazione – che è il valore? Come determinare il grado di ossidazione degli elementi?
Tale materia scolastica come la chimica provoca numerose difficoltà nella maggior parte degli studenti di oggi, pochissime persone potevano determinare il grado di ossidazione nei composti. La difficoltà maggiore nei bambini delle scuole che studiano chimica inorganica, che è, gli alunni delle scuole primarie (8-9 gradi). Oggetto equivoco porta a non gradire gli scolari al soggetto.
Gli insegnanti assegnano una serie di ragioni per questo allievi "dislike" in studenti delle scuole secondarie e superiori in chimica: la mancanza di volontà di comprendere i termini chimiche complesse, impossibilità di utilizzare algoritmi per un particolare processo, la conoscenza matematica del problema. Il Ministero della Pubblica Istruzione sono stati fatti grandi cambiamenti nel contenuto del soggetto. Inoltre, il "taglio" e il numero di ore per l'insegnamento della chimica. Questo influenzato negativamente la qualità delle conoscenze in materia, una diminuzione di interesse per lo studio della disciplina.

Che naturalmente argomenti di chimica offre agli studenti la più difficile?
Nell'ambito del nuovo programma nel corso della disciplina "Chimica" scuola di base include diversi importanti argomenti: tavola periodica degli elementi D. I. Mendeleeva, corsi di sostanze inorganiche, scambio ionico. Difficile definizione livellatrici dato stato di ossidazione ossidi.
regole di posizionamento
Prima di tutti gli studenti devono essere consapevoli che gli ossidi di due elementi sono composti complessi, in cui la composizione incluso ossigeno. Un composto binario prerequisito appartenente alla classe degli ossidi è ossigeno seconda posizione in un dato composto.
Calcolare tale indice in una determinata classe di formule si ottiene solo se lo studente ha un algoritmo specifico.
Algoritmo per ossidi acidi
Per cominciare, notiamo che il grado di ossidazione è un'espressione numerica della valenza degli elementi. ossidi acidi formati non-metalli o metalli con una valenza di quattro a sette, un secondo è richiesta in tali ossidi è ossigeno.
Gli ossidi ossigeno valenza sempre corrisponde a due, può essere fissa in funzione elementi della tavola periodica D. I. Mendeleeva. Questo è un tipico non-metallo come ossigeno, mentre nel gruppo 6 della tavola periodica del sottogruppo principale, accetta due elettroni, per completare pienamente il suo livello di energia esterna. Non metallici nei composti ossigenati spesso mostrano la valenza più alta che corrisponde al numero del gruppo stesso. È importante ricordare che il grado di ossidazione degli elementi chimici è un indicatore ipotizzando un numero positivo (negativo).
permanente metalloide all'inizio di una formula ha uno stato di ossidazione positivo. ossidi non metallici in ossigeno-stabile, la sua -2 rifrazione. Al fine di verificare l'esattezza della allineamento dei valori degli ossidi acidi necessario moltiplicare tutti i numeri che mette sugli indici del particolare elemento. I calcoli sono considerate valide se si ottiene la somma totale di tutti i pro ei contro dei set 0 gradi.

Preparazione di formulazioni a due elementi
Il grado di ossidazione di elementi atomici ha la possibilità di creare e registrare un composto di due elementi. Quando si crea una formula per l'avvio di entrambi i simboli vicino prescritto, accuratamente secondo somministrare ossigeno. Sulla parte superiore di ciascuno dei marchi registrati valore prescritto dei gradi di ossidazione, quindi pensa tra i numeri è il numero che sarà senza divisibile per entrambi i numeri. L'indicatore deve essere diviso individualmente dal valore numerico del grado di ossidazione per ottenere indici per il primo e secondo componenti del materiale a due elementi. Elevato stato di ossidazione è numericamente uguale al valore più elevato valenza tipico metalloide è identico al numero di gruppo, in cui il PS è un metalloide.
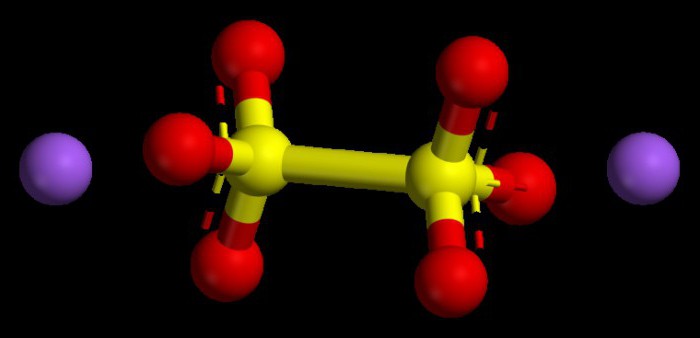
Le prestazioni algoritmo valori numerici rappresentati nelle ossidi basici
Tali composti sono considerati ossidi metallici tipici. Essi sono tutti i composti avevano un tasso dello stato di ossidazione di non più di uno o due. Per capire quale sarà il grado di ossidazione del metallo, è possibile sfruttare il sistema periodico. Nei metalli principali sottogruppi del primo gruppo, questa opzione è sempre costante, è simile al numero del gruppo, che è uno.
Metalli sottogruppo principale del secondo gruppo sono inoltre caratterizzati da uno stato di ossidazione +2 stabile numericamente. Il grado di ossidazione della quantità di ossidi di vista dei loro indici (numeri) dovrebbe dare zero, perché la sostanza chimica è considerata una molecola neutra, priva di una particella carica.
L'allineamento di ossidazione degli acidi ossigenati
Acidi sono sostanza complessa composta da uno o più atomi di idrogeno che sono associati con un residuo di acido. Dato che il grado di ossidazione è un obiettivi numerici per il loro calcolo richiede alcune abilità matematiche. un tale indicatore di idrogeno (protoni) sempre stabile in acidi, è +1. Inoltre è possibile indicare il grado di ossidazione dello ione negativo dell'ossigeno, è anche stabile, -2.
Solo dopo questa procedura, è possibile calcolare il grado di ossidazione del componente centrale della formula. Come esempio specifico considerare elementi determinanti il grado di ossidazione in acido solforico, H2SO4. Dato che nella molecola della sostanza complesso contiene due protoni idrogeno, 4 atomi di ossigeno, si ottiene un'espressione della forma + 2 + X-8 = 0. Per riassumere formata zero y è il grado di ossidazione dello zolfo +6
L'allineamento di ossidazione dei sali
Sali sono composti complessi costituiti da ioni metallici e uno o più anioni. Metodi per determinare il grado di ossidazione di ciascuno dei componenti del sale complesso è la stessa di acidi contenenti ossigeno. Dato che il grado di ossidazione di elementi – un indicatore digitale, è importante per indicare il grado di ossidazione del metallo.
Se la formazione del sale metallico è nel sottogruppo principale, il suo stato di ossidazione è stabile, corrispondente al numero del gruppo è positivo. Se il sale contiene un metallo come sottogruppi PS presentante diverse valenze determinano la valenza del metallo può essere il residuo di acido. Quando il grado di ossidazione del metallo da installare, mettere il grado di ossidazione di ossigeno (-2), seguito dal calcolo del grado di ossidazione del corpo centrale utilizzando l'equazione chimica.
Come esempio, si consideri la definizione di stati di ossidazione per gli elementi del nitrato di sodio (sale normale). NaNO3. Sol sottogruppo principale del gruppo 1 metallo è formato, quindi, il grado di ossidazione di sodio è +1. Al ossigeno in stato nitrato ossidazione di -2. Per determinare il valore numerico della ossidazione equivale + 1 + X-6 = 0. Risolvendo questa equazione, si ottiene che X deve essere 5, questo è il grado di ossidazione di azoto.

Termini chiave nella IAD
Ci sono condizioni speciali che sono necessarie per imparare gli studenti per il processo di ossidazione e riduzione.
Il grado di ossidazione è la sua capacità di dirigere collegare a se stesso (che invia differenti) elettroni da alcuni degli ioni o atomi.
L'ossidante è considerato atomi neutri o ioni durante la reazione chimica si unisce elettroni.
L'agente riducente sarà atomi non cariche o ioni che, nel processo di interazione chimica perdono le loro elettroni.
Il procedimento di ossidazione è rappresentato come impatto elettronico.
Recupero è associato con l'adozione di elettroni supplementari atomo non caricato o ione.
processo redox è caratterizzato dalla reazione, nel corso della quale necessariamente cambia il grado di ossidazione di un atomo. Questa definizione ci permette di capire come sia possibile determinare se la reazione di ISI.

regole di analisi OVR
Utilizzando questo algoritmo, i coefficienti possono essere disposti in qualsiasi reazione chimica.
-
In primo luogo è necessario inserire in ogni stato di ossidazione chimica. Si noti che un semplice questione stato di ossidazione zero, in quanto non v'è alcun dell'uscita (collegamento) di particelle negative. Termini di posizionamento di ossidazione in composti binari e tre elementi sono stati esaminati da noi sopra.
-
Allora è necessario individuare tali atomi o ioni che si sono verificati durante la conversione, ossidazione cambiato.
-
Registrato dal lato sinistro dell'equazione è atomi isolati o ioni che hanno cambiato grado di ossidazione. È necessario che il bilancio. Nel corso degli elementi necessari per indicare il loro valore.
-
Ulteriori scritto quelle atomi o ioni che si formano durante la reazione, un segno + indica il numero di elettroni atomi accettato, – il numero di particelle del cast negative. Se il processo di interazione sono ridotti stato di ossidazione. Ciò significa che gli elettroni sono stati presi atomo (ione). Quando il grado di ossidazione atomo (ione) di donare elettroni durante la reazione.
-
Il numero totale minima adottate per dividere il primo, poi gettato durante elettroni coefficienti ottenuti. numeri a virgola sono i fattori stereochimica richiesti.
-
Determinare ossidante, riducente, i processi che si verificano durante la reazione.
-
Il passo finale sarà l'allineamento dei fattori stereochimica in questa reazione.
esempio OVR
Consideriamo un'applicazione pratica dell'algoritmo in una particolare reazione chimica.
Fe + CuSO4 = Cu + FeSO4
Calcoliamo tutte le sostanze semplici e complessi.
Poiché Fe e Cu sono sostanze semplici, il loro stato di ossidazione è 0. In CuSO4, Cu + 2, quindi 2 ossigeno, zolfo ed a +6. In FeSO4: Fe +2, quindi, per una O 2, calc S +6.
Sono ora alla ricerca di elementi che potrebbero cambiare le cifre, nella nostra situazione, che saranno di Fe e Cu.
Poiché il valore dopo la reazione in atomo di ferro è stato 2, 2 elettroni è stato dato nella reazione. Rame loro indici cambiati a 0 a 2, quindi il rame ha 2 elettroni. Definiamo ora il numero di elettroni ricevuti, e gettato atomo di ferro e cationi rameico. Durante la conversione taken catione due elettroni rameico stesso electron proposta ferro atomo.
In questo processo non rilevanti per determinare il minimo comune multiplo, adottata e proposta durante la conversione uguale numero di elettroni. Fattori stereochimica saranno inoltre conformi a uno. Nella reazione dell'agente riducente esporrà proprietà di ferro, mentre è ossidato. rame catione bivalente è ridotto a rame puro nella reazione ha il più alto grado di ossidazione.

processo di applicazione
Grado Formula di ossidazione dovrebbe essere noto a ogni classe scolaro 8-9, in quanto questo problema è incluso nel lavoro OGE. Tutti i processi che si verificano con ossidanti, ridurre i sintomi, svolge un ruolo importante nella nostra vita. Sono processi metabolici indispensabili nel corpo umano.














