Che cosa è allotropia? allotropo di carbonio, Chemistry
Ragioni varietà di composti organici – la capacità di formare differenti catene atomi di carbonio e cicli sono interconnessi. Questo è il fenomeno della isomeria. E la ragione per la varietà di semplici sostanze inorganiche? Si scopre che si può rispondere a questa domanda considerando quello Allotropy. E 'con questo fenomeno naturale del mondo degli elementi chimici si legano l'esistenza di diverse forme di composti semplici.
Che cosa è allotropia?
Rispondere a questa domanda può essere così. Questo fenomeno è l'esistenza dello stesso elemento chimico in forma di varie sostanze semplici. Cioè, se la cella 118 della tavola periodica, ciò non significa che lo stesso numero di atomi in natura. Ciascuno degli elementi (quasi tutti) hanno uno o più varietà, o modifiche allotropiche.
Ciò che è diverso tali sostanze? Le ragioni del fenomeno in questione sono sostanzialmente due:
- un diverso numero di atomi nella molecola (allotropy composizione);
- struttura reticolare disuguale (allotropy forma).
Spesso il concetto è associato con il termine polimorfismo. Tuttavia, v'è una differenza tra di loro. Che cosa è allotropia? Questa modifica degli elementi chimici in diverse sostanze semplici, indipendentemente dal fatto che sia in qualsiasi stato di aggregazione. Mentre il polimorfismo – questo concetto è applicabile solo alle solide sostanze cristalline.
Varie forme allotropiche composti generalmente indicate con lettere romani prima del nome. Alfa è sempre posto di fronte alla forma, che ha una temperatura minima di fusione di ebollizione. Più in basso l'alfabeto e un aumento delle prestazioni, rispettivamente.
Sebbene l'elemento chimico in base semplice sostanza, le stesse modifiche proprietà significativamente diversi tra loro, e sia fisica che chimica. Il modo più semplice per formare le forme allotropiche:
- non metallici (eccetto alogeni e gas inerti);
- semimetalli.
Almeno Allotropy metalli studiati poiché essi formano un riluttante tali modifiche e non tutti. Totale fino ad oggi ci sono più di 400 diversi tipi di sostanze semplici. Il più ossidazione caratteristica dell'elemento, maggiore è il numero delle note forme allotropiche ad esso.

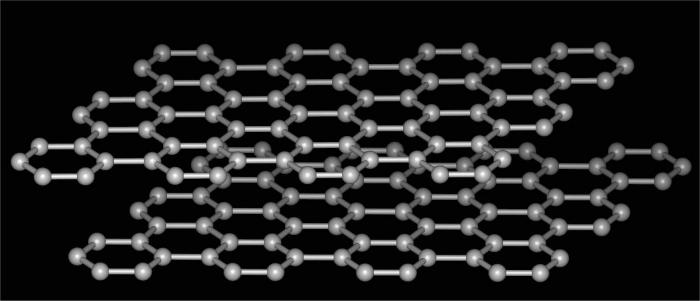
modifiche carbonio
allotropo di carbonio – è l'esempio più comune e sorprendente che illustra il fenomeno in questione. Dopo tutto, questo elemento è in grado di formare diversi tipi di composti diversa struttura del reticolo cristallino. In questa immagine di una sostanza semplice tali poli opposti nelle loro proprietà che le decisioni sono lasciate alla meraviglia della natura.
Così, un allotropo di carbonio comprende le seguenti modifiche.
- Ciò è un allotropo di carbonio, possono essere rintracciati e successiva sua forma, che è fondamentalmente differente da quello precedente. Questo grafite. Molto sostanza molle, che può sfaldarsi facilmente e lascia un segno distintivo sulla carta. Pertanto, il suo uso per la produzione di maniglie sono semplici matite. La struttura di questa forma – lo stratificata esagonale. Collegamenti fra strati sono deboli, facilmente strappato, materiale a bassa densità. Grafite è utilizzato per produrre diamanti sintetici come il lubrificante solido, per la fabbricazione di elettrodi come plastiche riempitivo, e nei reattori nucleari.
- I fullereni – un'altra prova che ci Allotropy. Chimica di questi composti è simile a quella degli idrocarburi aromatici. Perché la loro struttura è convessa poliedri chiuso, simile a un pallone da calcio. Fullereni vengono applicate come un semiconduttore nella tecnica per la produzione di composti superconduttori come photoresist ed altri.
- tserafit Lonsdalite e – due ulteriore modificazione cristallina allotropica del carbonio. E 'stato scoperto in tempi relativamente recenti. Da proprietà molto simili al diamante, in assenza di impurità può essere ancora più difficile parecchie volte.
- Carbone e fuliggine – Allotropy sostanze amorfe. Usato come carburanti, lubrificanti, filtri e così via. Secondo il contenuto nella natura della più comune di tutte le modifiche di carbonio.

diamante
Il più duro di tutte le sostanze conosciute finora, stimato a 10 punti sulla scala Mohs. La forma cristallina del carbonio, che la struttura è della forma correttamente interconnessi entità di rete tetraedrici.
Diamante è molto ben in grado di diffondere la luce, può essere utilizzato come gioielli (diamanti). Grazie alla sua estrema durezza, viene utilizzato per il taglio e saldatura, foratura, lucidatura e molatura. Ha lanciato oggi la produzione di diamanti artificiali utilizzati nell'industria.
altre specie
Inoltre, ci sono diverse varietà di questo elemento:
- nanotubi;
- nanoschiuma;
- Astrolite;
- nanofibre;
- vetroso;
- di grafite;
- carabina;
- nanobuds.
forme probabili, ma putativi di esistenza di composti di carbonio semplice: chaoit, carbonio e dicarbon metallo.
allotropia ossigeno
Questa forma due metalloide sostanza semplice:
- gas ossigeno (in condizioni normali), la cui formula O 2;
- gas ozono, la composizione empirica cui riflessione O 3.
E 'ovvio che qui è la ragione principale per l'esistenza di modifiche – della molecola. Normale ossigeno – la base della vita per tutti gli esseri viventi (tranne che per i batteri anaerobi). Lui è un partecipante attivo nello scambio di gas, la fonte di energia per tutti i processi vitali. Chimicamente – ossidante, per cui viene eseguita una pluralità di reazioni.
L'ozono è formato in natura o attrezzature di laboratorio speciale ozonizzatori ossigeno da aria da una scarica elettrica forte. In condizioni naturali – è un fulmine. A basse concentrazioni di traccia ha un piacevole fresco odore (dopo la tempesta sempre sentito in aria). Si tratta di un ossidante molto forte, candeggina, chimicamente attivo.

modifica fosforo
Allotropy ossigeno è simile a quella di fosforo e. Ha anche circa 11 diverse modificazioni numero di atomi differenti nella molecola, e quindi, un legame chimico e le proprietà. Ci sono tre forme stabili, e il resto, nella natura praticamente non si verifica, e decomposizione.
- Il fosforo bianco. E Formula F 4. Una sostanza simile a vaselina bianca o colore leggermente giallastro. E 'facile a sciogliersi, trasformandosi in gas velenosi.
- fosforo rosso – una pasta, che ha un odore sgradevole. Formula – P n. Questa struttura polimerica.
- Nero fosforo – untuosa al tatto di peso, che è di colore nero e completamente solubile in acqua.
modifica metallo
Qual è allotropia metalli, può essere trovato sul l'esempio di ferro. Esiste nella forma di:
- alfa;
- beta;
- gamma;
- forma sigma.
Ogni differisce dalla precedente struttura del reticolo cristallino e, di conseguenza, le proprietà. Ad esempio, alfa-forma – ferromagnetichna e beta -paramagnetik.
In generale, tutti i metalli conosciuto da modifica allotropica per formare un totale di 27 elementi chimici.

tin allotropia
Interessante dal fatto che l'alfa-forma – una polvere grigia, che esiste solo a basse temperature. Beta-form, d'altra parte, metallo, bianco-argenteo, morbido e duttile. C'è ad elevate prestazioni termiche – fino a 161 ° C Una forma viene facilmente convertito in un altro in vivo, se goccia gradi.












