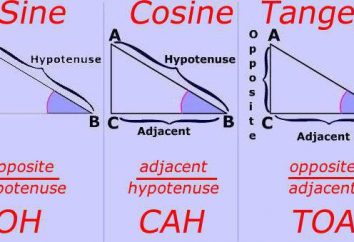
Metodo semireazione: algoritmo
Molti processi chimici testati con i gradi di cambiamento di ossidazione degli atomi che costituiscono il composto reattivo. Scrivendo reazioni equazioni di tipo redox è spesso accompagnata da difficoltà nel fissare i coefficienti prima di ogni sostanze formula. A questo scopo, sono stati sviluppati metodi riguardante l'equilibrio distribuzione della carica elettronica o elettronica ionico. L'articolo descrive la seconda strada su per le equazioni.
Metodo semireazione, l'essenza
Egli ha anche elettrone-ione moltiplicatori dei coefficienti di distribuzione equilibrio. Secondo i metodi di scambio di particelle caricate negativamente tra anioni o cationi nel mezzo di dissoluzione con diversi pH. 
Nelle reazioni di tipo ossidativo e riduttivo elettroliti coinvolto con ioni negativi o carica positiva. Equazioni specie ionica molecolare, metodo reazione metà base è coinvolto, dimostrano chiaramente l'essenza di qualsiasi processo.
Per formare l'equilibrio di elettroliti utilizzando una speciale notazione forte collegamento come particelle ionici e collegamenti allentati, e depositi di gas sotto forma di molecole indissociate. La composizione deve indicare circuiti particelle che modificano il loro grado di ossidazione. Per determinare il mezzo di dissoluzione in equilibrio denota acido (H +), alcali (OH -) (2 O H) e condizioni neutre.
Per quale uso?
Il metodo WRA è diretto alle equazioni mezzo di reazione scrittura ionico separatamente per processi di ossidazione e riduzione. Il saldo finale sarà la loro somma.
fasi di attuazione
La scrittura ha il suo metodo di mezza reazione proprie peculiarità. L'algoritmo comprende le seguenti fasi:
– Il primo passo è quello di scrivere le formule per tutti i reagenti. Ad esempio:
H 2 S + KMnO 4 + HCl
– Allora è necessario installare la funzione da un punto di vista chimico, ogni componente del processo. In questa reazione, KMnO 4 agisce come ossidante, H 2 S è un agente riducente e HCl definisce un ambiente acido. 
– Il terzo passo deve essere scritto su una nuova linea formula composti ionici reagire con un forte potenziale elettrolita atomi di cui v'è un cambiamento di gradi di ossidazione. In questa reazione MnO 4 – agisce come agente ossidante, H 2 S è il reagente riducente e H + ossonio catione o H 3 O + definisce un ambiente acido. Il composto elettrolitica gassosa, solida o debole espresso formule molecolari intatti.
Conoscendo i componenti di partenza, per cercare di determinare quale tipo di ossidante e agente riducente sarà ridotto e la forma ossidata, rispettivamente. A volte le sostanze finali sono state già specificato nelle condizioni, che facilita il lavoro. Le seguenti equazioni indicano transizione H 2 S (solfuro di idrogeno) a S (zolfo), e l'anione MnO 4 – a Mn 2+ catione.
Per l'equilibrio delle particelle atomiche nella parte sinistra e destra in ambiente acido si aggiunge idrogeno catione H + o un'acqua molecolare. La soluzione alcalina è stato aggiunto ioni idrossido OH – o H 2 O.
MnO 4 – → Mn 2+
In una soluzione di un atomo di ossigeno insieme con ioni manganatnyh forma H + molecole d'acqua. Per pareggiare il numero di elementi è scritta come l'equazione: 8H + + MnO 4 – → 4H 2 O + Mn 2+.
Poi, il bilanciamento viene eseguita l'elettricità. Per fare questo, si consideri la quantità totale di carica residua nella zona, si trasforma sette, e poi verso il lato destro, due uscite. Per bilanciare il processo viene aggiunto ai materiali di partenza cinque particelle negative: 8H + + MnO 4 – + 5e – → 4H 2 O + Mn 2+. Si scopre mezza reazione di recuperare.
Ora equalizzare il numero di atomi di essere processo di ossidazione. A questo si aggiunge ai giusti cationi lato idrogeno: H 2 S → 2H + + S.
Dopo equalizzazione carica viene eseguita: H 2 S -2E – → 2H + + S. Si è visto che i composti di partenza consumano due particelle negative. Risulta metà di reazione del processo di ossidazione. 
Registrare le due equazioni in una colonna e linea il cast e gli oneri accettati. Secondo la regola viene selezionata la determinazione del minimo multipla per ogni mezza reazione il moltiplicatore. È moltiplicata per ossidativo e equazione riduttiva.
Ora è possibile effettuare la somma dei due fogli, piegati lati sinistro e destro insieme e riducendo il numero di specie elettronici.
8H + + MnO 4 – + 5e – → 4H 2 O + Mn 2+ | 2
H 2 S -2E – → 2H + + S | 5
16H + + 2MnO 4 – + 5H 2 S → 8H 2 O + 2Mn 2+ + 10H + + 5S
L'equazione risultante può ridurre il numero di H + 10: 6H + + 2MnO 4 – + 5H 2 S 2 O → 8H + 2Mn 2+ + 5S.
Controlliamo la correttezza del bilanciamento ionico contando il numero di atomi di ossigeno alle frecce e dopo di esso, che è uguale a 8. E 'anche necessario per verificare le spese finali, e la parte iniziale del saldo: (+6) + (-2) = 4. Se tutto corrisponde, è scritto correttamente.
Metodo semireazione termina con la transizione dalla registrazione ione molecolare all'equazione. Per ogni particella porzione anionico e cationico del saldo rimanente sul ione selezionata carica opposta. Poi vengono trasferiti al lato destro, nella stessa quantità. Ora, gli ioni possono essere collegati a tutta la molecola.
6H + + 2MnO 4 – + 5H 2 S → 8H 2 O + 2Mn 2+ + 5S
6CL – + 2K + → 6CL – + 2K +
H 2 S + KMnO 4 + 6HCl → 8H 2 O + 2MnCl 2 + 5S + 2KCl.
Applicare il metodo di mezze reazioni, l'algoritmo che è quello di scrivere l'equazione molecolare, esso può insieme con il tipo di scrittura bilance elettroniche.
Determinazione di agenti ossidanti
Questo ruolo è giocato da entità ionici, atomici o molecolari che ricevono elettroni con carica negativa. sostanze ossidanti subiscono restauro nelle reazioni. Hanno inconveniente elettronico, che può essere facilmente riempito. Tali processi includono redox mezzo di reazione. 
Non tutte le sostanze hanno la possibilità di allegare elettroni. Con forti reagenti ossidanti comprendono:
- rappresentanti alogeno;
- acido come nitrico, solforico e selenio;
- permanganato di potassio, dicromato, manganatny, cromato;
- manganese tetravalenti e ossidi di piombo;
- argento e ioni di oro;
- ossigeno gassoso composto;
- bivalente ossidi di rame e argento monovalente;
- contenente cloro componenti salini;
- vodka reale;
- perossido di idrogeno.
Determinazione di ridurre
Questo ruolo appartiene ionica, particelle atomiche o molecolari, che danno una carica negativa. Nelle reazioni sostanze riducenti subire effetto ossidativo sulla scissione di elettroni.
Hanno proprietà riducenti :
- I rappresentanti di molti metalli;
- composti di zolfo tetravalenti e solfuro di idrogeno;
- acidi alogeni;
- ferro, cromo, manganese e solfato;
- cloruro stannoso;
- contenenti azoto agenti come nitroso acido, ossido di stagno, idrazina e ammoniaca;
- naturale del carbonio e l'ossido bivalente;
- molecola di idrogeno;
- acido fosforoso.
I vantaggi del metodo di elettrone-ione
Per scrivere una reazione redox, metodo mezzo di reazione viene utilizzato più spesso rispetto al saldo tipo elettronico. 
Ciò è dovuto ai vantaggi Metodo elettrone-ione :
- Al momento di scrivere l'equazione considerando gli ioni effettivi e composti che esistono come parte della soluzione.
- Non si può avere inizialmente informazioni su come ottenere il composto, essi sono determinati nelle fasi finali.
- Non sempre i dati necessari sul grado di ossidazione.
- A causa del metodo è possibile conoscere il numero di elettroni coinvolti nel mezzo di reazione come cambiando il valore pH della soluzione.
- Dalle equazioni ridotte specie ioniche caratteristica dei processi e la struttura dei composti risultanti studiati.
Semireazione in soluzione acida
Effettuare i calcoli con ioni idrogeno in eccesso obbedisce l'algoritmo di base. Metodo mezzo di reazione in ambiente acido con una registrazione inizio parte di qualsiasi processo. Poi sono stati espressi in forma di equazioni delle specie ioniche nel rispetto dell'equilibrio della carica atomica ed elettronica. Separatamente registrato processi di carattere ossidativo e riduttivo.
Per allineare l'ossigeno atomico a lato reazioni con un eccesso portare le sue cationi idrogeno. Le quantità di H + dovrebbero essere sufficienti per ottenere l'acqua molecolare. Oltre carenza di ossigeno attribuito H 2 O.
Quindi effettuato l'equilibrio di atomi di idrogeno ed elettroni.
Fare una sommatoria di equazioni, prima e dopo la freccia con la disposizione dei coefficienti. 
Eseguire la stessa riduzione di ioni e molecole. Da reagenti già registrati in un totale aggiunta dell'equazione mancante operare anionici e cationici specie. Il loro numero, prima e dopo la freccia deve corrispondere.
Equazione OVR (metodo semireazione) è considerata soddisfatta quando crei un'espressione finito delle specie molecolari. Accanto a ogni componente deve essere un certo fattore.
Esempi di condizioni acide
La reazione di nitrito di sodio con acido cloridrico porta alla produzione di nitrato di sodio e acido cloridrico. Per la disposizione dei coefficienti utilizzando il metodo di semireazioni, esempi di equazioni scrittura associati con l'indicazione della ambiente acido.
NaNO 2 + 3 HClO → Nano 3 + HCl
ClO 3 – + 6H + + 6e – → 3H 2 O + Cl – | 1
NO 2 – + H 2 O – 2e – → NO 3 – + 2H + | 3
ClO 3 – + 6H + + 3H 2 O + 3NO 2 – → 3H 2 O + Cl – + 3NO 3 – + 6H +
ClO 3 – + 3NO 2 – → Cl – + 3NO 3 –
3NA + + H + → 3NA + + H +
3NaNO 2 + 3 HClO → 3NaNO 3 + HCl.
In questo processo, un nitrito di nitrato di sodio è ottenuto, e dall'acido cloridrico forma un sale. modifiche grado di ossidazione con azoto da 3 a 5, e la carica cloro 5 diventa -1. Entrambi i prodotti non formano un precipitato.
Metà-reazione a un ambiente alcalino
Condurre calcoli quando ioni idrossido in eccesso corrisponde ai calcoli per soluzioni acide. Metodo mezzo di reazione in ambiente alcalino anche cominciare a esprimere componenti del processo in forma di equazioni ioniche. Le differenze osservate durante l'allineamento di ossigeno atomico. Così, a parte la sua reazione con un eccesso molecolare portare l'acqua, e sul lato opposto aggiunge anioni idrossido.
Il coefficiente della molecola di H 2 O indica la differenza nella quantità di ossigeno prima e dopo la freccia, e per gli ioni OH – è doppio. Durante agente ossidante che agisce come agente riducente prende atomi di O da anioni idrossili.
Metodo metà reazione termina eseguire i passaggi rimanenti dell'algoritmo, che coincidono con i processi che hanno un eccesso di acido. Il risultato finale è l'equazione della specie molecolari.
Esempi per mezzo alcalino
Quando si miscela con idrossido di iodio formata ioduro di sodio e sodio iodato, di molecole d'acqua. Per processo bilancia con metà metodo reazione. Esempi di soluzioni alcaline hanno le specifiche relative alla perequazione di ossigeno atomico.
NaOH + I 2 → NaI + NaIO 3 + H 2 O
I + e – → I – | 5
6OH – + I – 5e – → I – + 3H 2 O + IO 3 – | 1
I + 5I + 6OH – → 3H 2 O + 5I – + IO 3 –
6NA + → Na + + + 5NA
6NaOH + 3I 2 → 5NaI + NaIO 3 + 3 H 2 O. 
Il risultato della reazione è la scomparsa della colorazione viola di iodio molecolare. V'è un cambiamento di stato di ossidazione dell'elemento da 0 a 1 e 5 per formare ioduro e iodato di sodio.
Reazione in ambiente neutro
Tipicamente si riferisce ai processi che si verificano nel idrolisi per formare sali di acidi deboli (con pH compreso tra 6 e 7) o debolmente basico (a pH 7 a 8) soluzione.
Metodo reazione metà in ambiente neutro viene registrato in diverse versioni.
Nel primo metodo non prende in considerazione l'idrolisi del sale. Il mezzo è preso come il neutro ea sinistra della freccia attributo acqua molecolare. In questa forma di realizzazione, un semireazioni prendono per l'acido, e un altro – per alcalina.
Il secondo metodo è adatto per processi in cui è possibile stabilire il valore approssimativo di pH. Poi la reazione per il metodo di ione-elettrone considerato in una soluzione alcalina o acida.
ESEMPIO ambiente neutro
Quando composto di idrogeno solforato con bicromato di sodio in acqua è ottenuta zolfo precipitato, sodio e idrossido di cromo trivalente. Questa è una tipica risposta per una soluzione neutra.
Na 2 Cr 2 O 7 + H 2 S + H2O → NaOH + S + Cr (OH) 3
H 2 S – 2e – → S + H + | 3
7H 2 O + Cr 2 O 7 2- + 6e – → 8OH – + 2Cr (OH) 3 | 1
7H 2 O + 3H 2 S + Cr 2 O 7 2- → 3H + + 3S + 2Cr (OH) 3 + 8OH -. cationi e anioni di idrogeno idrossido se combinati, formano un 6 molecole di acqua. Essi possono essere rimossi in destra e sinistra, lasciando l'eccesso alla freccia.
H 2 O + 3H 2 S + Cr 2 O 7 2- → 3S + 2Cr (OH) 3 + 2OH –
2na + → 2na +
Na 2 Cr 2 O 7 + 3H 2 S + H 2 O → 2NaOH + 3S + 2Cr ( OH) 3
Al termine della reazione un precipitato di idrossido di cromo colori zolfo blu e giallo nella soluzione alcalina con idrossido di sodio. Il potere ossidante dell'elemento S diventa -2 a 0, e caricato con cromo +6 convertito 3.