Che cosa è la proprietà colligative?
Le soluzioni – è sistemi omogenei che comprendono due o più componenti, così come i prodotti derivanti dalla interazione di questi componenti. Essi possono essere in forma solida, liquida o gassosa. Considerate le soluzioni liquide stato di aggregazione. Nella loro composizione comprende un solvente e una sostanza disciolto (ultimo meno).
Colligative proprietà – loro caratteristiche sono quelli che sono in proporzione diretta solo del solvente e concentrazione della soluzione. Essi sono chiamati anche il collettivo o condiviso. Proprietà colligative sono mostrati nelle miscele, in cui non vi sia interazione tra la natura chimica dei componenti. Inoltre, l'azione reciproca delle forze tra le particelle e le particelle di solvente-solvente e sciolto in esso una sostanza sono soluzioni ideali.
Proprietà colligative:
1) La tensione di vapore sopra la soluzione è inferiore al solvente sopra.
2) La cristallizzazione della soluzione è ad una temperatura inferiore alla temperatura di cristallizzazione di solvente in forma pura.
3) bollire la soluzione avviene ad una temperatura superiore a quella di ebollizione del solvente.
4) Il fenomeno di osmosi.
Considerare proprietà colligative singolarmente.
L'equilibrio all'interfaccia in un sistema chiuso: liquido – tensione di vapore è caratterizzata da vapori saturi. Poiché in soluzione porzione strato superficiale è riempito con le molecole del soluto, l'equilibrio viene raggiunto a un valore inferiore della pressione del vapore.
La seconda proprietà Collegiata – ridurre la temperatura di cristallizzazione rispetto al solvente della soluzione – a causa del fatto che le particelle del soluto per ostacolare la costruzione dei cristalli e quindi impediscono la cristallizzazione a bassa temperatura.
Il punto di ebollizione della miscela è maggiore del solvente in forma pura, a causa del fatto che l'uguaglianza pressione atmosferica, e la tensione di vapore è ottenuta attraverso l'alta temperatura perché una parte delle molecole di solvente associate con le particelle del soluto.

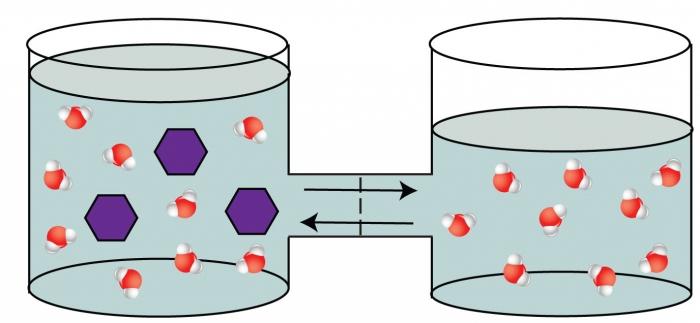
Quarto proprietà colligative – il fenomeno di osmosi.
osmosi – la capacità di migrare attraverso il solvente separazione che è permeabile per alcune particelle (molecola di solvente) e impermeabili agli altri (molecola di soluto). Questa partizione separa la soluzione con un elevato contenuto di soluto dalla soluzione meno concentrata. Un esempio di una partizione come semipermeabile può servire come una membrana di una cellula vivente, bovini, ecc bolla. Fenomeno osmosi causato dalla perequazione concentrazione su entrambi i lati separate da una membrana che è termodinamicamente più favorevole per il sistema. Dovuti allo spostamento del solvente in una soluzione più concentrata in questa parte del vaso v'è un aumento della pressione. Questa pressione eccessiva è stato chiamato osmotica.
Proprietà colligative di soluzioni di elettroliti non possono essere rappresentati matematicamente dalle equazioni:
. Δ bp = Ekip ∙ Sede;
Δ T c. = ∙ Kzam Sede;
π = CRT.
Proprietà colligative figura per diverse soluzioni di elettroliti e soluzioni nonelectrolytes. Per i primi, sono un po 'di più. Ciò è dovuto al fatto che si verificano in dissociazione elettrolitica, e la quantità di particelle aumenta notevolmente.
Proprietà colligative sono ampiamente utilizzati in casa e nei luoghi di lavoro, per esempio, l'osmosi viene utilizzato per la produzione di acqua pura. Negli organismi viventi, molti dei sistemi sono anche costruiti sulle proprietà colligative (come l'aumento di cellule vegetali).